¿Por qué las reacciones tienen lugar a diferentes velocidades? Por qué algunas ocurren rápidamente y otras proceden muy lentamente? Por qué la misma reacción puede proceder a diferentes ritmos bajo diferentes condiciones? Hay una serie de factores que influyen en las velocidades de reacción, pero este artículo se centra en la barrera de activación.
Una barrera de activación es una especie de obstáculo energético que una reacción debe superar. Algunas reacciones tienen barreras más altas y otras tienen barreras más bajas. Es más fácil superar las barreras más bajas, por lo que las reacciones con barreras de activación bajas pueden proceder más rápidamente que las que tienen barreras de activación más altas:
- Una barrera de activación baja permite que una reacción se produzca rápidamente.
- Una barrera de activación alta hace que una reacción proceda más lentamente.
- Incluso si una reacción desprende energía en general, se debe agregar energía inicialmente para que la reacción comience.
- Siempre le «cuesta» a una molécula energía entrar en una reacción; «toma prestada» esa energía de su entorno.
- Esa inversión inicial de energía puede ser «devuelta» a medida que la reacción avanza.
-
El estado de transición es inherentemente una estructura inestable de alta energía con un tiempo de vida muy corto. Tan pronto como se forma, desaparece.
Una reacción puede ser exergónica en general, pero seguir teniendo una barrera de activación al principio. Incluso si el sistema disminuye en energía al final de la reacción, generalmente experimenta un aumento inicial de energía.
Esta situación es similar a la inversión en un negocio. Un negocio generalmente requiere una inversión financiera para empezar. Si el negocio tiene éxito, con el tiempo fabricará productos y devolverá el dinero a los inversores. Si el negocio no puede recuperar su inversión inicial, puede fracasar.
Las reacciones requieren una inversión inicial de energía. Esta energía puede provenir de las moléculas circundantes o del entorno en general. Si la reacción tiene éxito, procederá a fabricar productos y emitirá energía de vuelta a su entorno.
Todas las reacciones deben superar barreras de activación para poder ocurrir. La barrera de activación es la suma de la energía que debe gastarse para que la reacción se produzca. Una barrera de activación se suele imaginar como una colina que los reactantes deben superar durante la reacción. Una vez allí, pueden deslizarse por el otro lado de la colina para convertirse en productos. En la cima de la colina, la molécula existe en lo que se llama «estado de transición». En el estado de transición, la estructura se encuentra en algún lugar entre su forma original y la estructura de los productos.
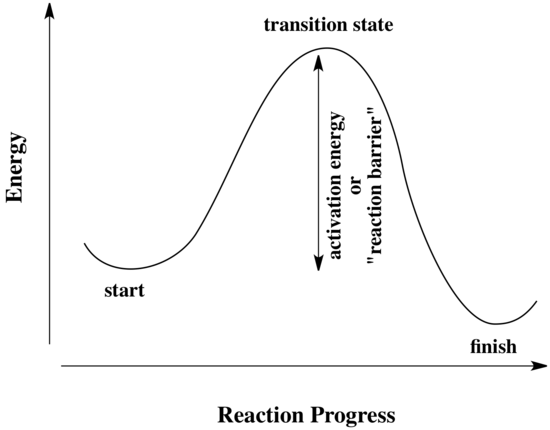
El tipo de diagrama mostrado arriba se llama a veces «diagrama de progreso de la reacción.» Muestra los cambios de energía en el sistema a medida que avanza una reacción. Pueden existir una o más barreras de activación a lo largo de las vías de reacción, debido a varios pasos elementales en la reacción.
Para entender más concretamente los términos «progreso de la reacción» y «estado de transición», considere una reacción real. Supongamos que un nucleófilo, como un ion acetiluro, dona sus electrones a un carbonilo electrófilo. El enlace π se rompe y se forma un ion alcóxido.

El «progreso de la reacción» se refiere a cuánto ha avanzado la reacción. El estado de transición se refiere específicamente al punto de mayor energía en el camino de los reactivos a los productos. Se refiere a la estructura en ese punto, y a la energía asociada a esa estructura.
En el siguiente diagrama, el término «progreso de la reacción» ha sido sustituido por una ilustración que hace coincidir el estado de la reacción con el punto correspondiente en la curva de energía. La estructura entre corchetes es el estado de transición, correspondiente al máximo de la curva. El símbolo de la «doble daga» indica una estructura de estado de transición.
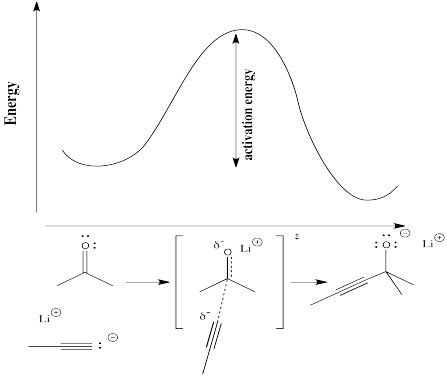
El estado de transición no es una verdadera estructura química. No obedece necesariamente a las reglas de las estructuras de Lewis, porque algunos enlaces nuevos han empezado a formarse y algunos enlaces antiguos han empezado a romperse; los enlaces parciales no tienen cabida en una estructura de Lewis.
Físicamente, la estructura del estado de transición no puede ser aislada. Debido a que se encuentra en la parte superior de una curva de energía, el estado de transición tiende a convertirse en otra cosa. Un cambio en cualquier dirección reducirá su energía. La tendencia es proceder a la energía más baja si es posible. Tan pronto como se forme el estado de transición, se deslizará de vuelta a los materiales de partida originales o se deslizará hacia adelante en los productos finales.
Contribuidores y atribuciones
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)