Enlaces Sigma y Pi
El modelo de hibridación ayuda a explicar las moléculas con enlaces dobles o triples (ver figura siguiente). El eteno \a la izquierda( \ce{C_2H_4} \a la derecha)\a contiene un enlace covalente doble entre los dos átomos de carbono y enlaces simples entre los átomos de carbono y los átomos de hidrógeno. Toda la molécula es plana.
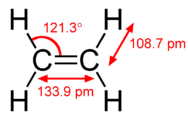
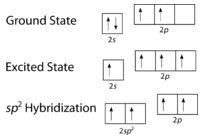
Como puede verse en la figura siguiente, la geometría del dominio de los electrones alrededor de cada carbono de forma independiente es trigonal plana. Esto corresponde a la hibridación \(sp^2\). Anteriormente, vimos que el carbono sufre hibridación \(sp^3\) en una molécula \(\ce{CH_4}\, por lo que la promoción de electrones es la misma para el eteno, pero la hibridación se produce sólo entre el único orbital \(s\) y dos de los tres orbitales \(p\). Así se genera un conjunto de tres híbridos \(sp^2\) junto con un orbital \(2p_z\) no hibridado. Cada uno de ellos contiene un electrón y, por tanto, es capaz de formar un enlace covalente.
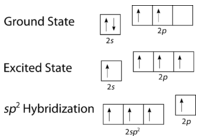
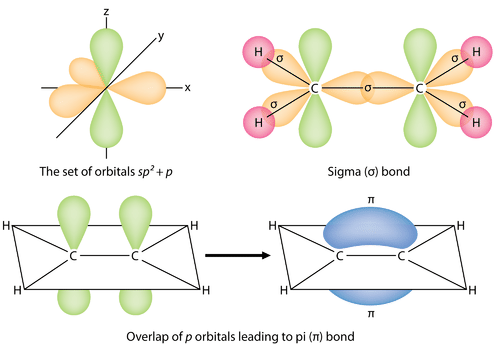
Los tres orbitales híbridos \2 se sitúan en un plano, mientras que el orbital \2p no hibridado está orientado perpendicularmente a ese plano. El enlace en \ce{C_2H_4} se explica como sigue. Uno de los tres híbridos \(sp^2\) forma un enlace al superponerse con el orbital híbrido idéntico en el otro átomo de carbono. Los dos orbitales híbridos restantes forman enlaces solapándose con el orbital \(1s\) de un átomo de hidrógeno. Por último, los orbitales \(2p_z\) de cada átomo de carbono forman otro enlace al solaparse entre sí lateralmente.
Es necesario distinguir entre los dos tipos de enlaces covalentes en una molécula \(\ce{C_2H_4}\. Un enlace sigma (\(\sigma\)) es un enlace formado por el solapamiento de orbitales de extremo a extremo, con la densidad de electrones concentrada entre los núcleos de los átomos enlazados. Un enlace pi (enlace \pi\) es un enlace formado por el solapamiento de orbitales de lado a lado, con la densidad de electrones concentrada por encima y por debajo del plano de los núcleos de los átomos enlazados. La figura siguiente muestra los dos tipos de enlace en el \ce{C_2H_4}. Los orbitales híbridos \(sp^2\) son de color púrpura y el orbital \(p_z\) es azul. Se forman tres enlaces sigma a partir de cada átomo de carbono para un total de seis enlaces sigma en la molécula. El enlace pi es el «segundo» enlace de los dobles enlaces entre los átomos de carbono y se muestra como un lóbulo verde alargado que se extiende por encima y por debajo del plano de la molécula. Este plano contiene los seis átomos y todos los enlaces sigma.
En una estructura convencional de puntos de electrones de Lewis, un doble enlace se muestra como un doble guión entre los átomos, como en \ce{C=C}. Sin embargo, es importante darse cuenta de que los dos enlaces son diferentes: uno es un enlace sigma, mientras que el otro es un enlace pi.
El etileno (\left( \ce{C_2H_2} \right)\Nes una molécula lineal con un triple enlace entre los dos átomos de carbono (véase la figura siguiente). La hibridación es, por tanto, \\Nespañola.
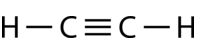
La promoción de un electrón en el átomo de carbono ocurre de la misma manera. Sin embargo, la hibridación involucra ahora sólo el orbital \(2s\) y el orbital \(2p_x\), dejando los orbitales \(2p_y\) y \(2p_z\) sin hibridar.
Los orbitales híbridos \(sp\) forman un enlace sigma entre ellos, así como enlaces sigma con los átomos de hidrógeno. Tanto los orbitales \(p_y\) como los \(p_z) de cada átomo de carbono forman enlaces pi entre sí. Como en el caso del eteno, estos solapamientos de lado a lado están por encima y por debajo del plano de la molécula. La orientación de los dos enlaces pi es que son perpendiculares entre sí (véase la figura siguiente). Un enlace pi está por encima y por debajo de la línea de la molécula, como se muestra, mientras que el otro está por delante y por detrás de la página.
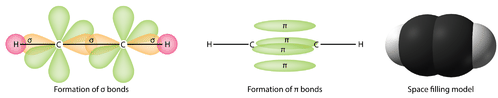
En general, los enlaces simples entre átomos son siempre enlaces sigma. Los dobles enlaces están formados por un enlace sigma y uno pi. Los enlaces triples están compuestos por un enlace sigma y dos enlaces pi.