Contribuidores principales – Tony Lowe, Tarina van der Stockt, Kim Jackson, Uchechukwu Chukwuemeka y Vidya Acharya
Introducción
El dolor del miembro fantasma(PLP) se define como «dolor localizado en la región de la parte del cuerpo extirpada» . Se trata de un fenómeno clínico poco conocido que sigue siendo objeto de intensa investigación debido a la naturaleza aguda y crónica de la afección. Se ha informado de que la incidencia es de hasta el 60-80% en los pacientes tras la amputación y los factores de riesgo incluyen el dolor crónico previo a la amputación, el dolor quirúrgico postoperatorio y el malestar psicológico.
- Dolores fantasma a menudo descritos como aplastamiento, torsión de los dedos del pie, hierro caliente, ardor, hormigueo, calambres, descargas, disparos, «alfileres & agujas»
- Tiende a localizarse en las estructuras fantasma más distales (p. ej. dedos de las manos y de los pies)
- Prevalencia en fases tempranas 60-80%
- Independiente de la edad en adultos, del sexo, del nivel o del lado de la amputación
- Cinéticas (movimiento)
- Cinestésicas (tamaño, forma, posición)
- Exteroceptivas (tacto, presión, temperatura, picor, vibración)
- Los nervios que quedan en el muñón crecen formando neuromas, que generan impulsos. Estos impulsos se perciben como dolor en el miembro que ha sido extirpado.
- Después de que se observaran cambios en la gravedad del dolor del miembro fantasma a diferentes temperaturas, otra teoría dice que el enfriamiento de las terminaciones nerviosas aumenta la velocidad de disparo de los impulsos nerviosos, que son percibidos por el paciente como dolor del miembro fantasma
- Melzack propuso que el cuerpo está representado en el cerebro por una matriz de neuronas. Las experiencias sensoriales crean una neuromatriz única, que queda impresa en el cerebro. Cuando se extrae el miembro, la neuromatriz intenta reorganizarse, pero la neurosignatura permanece debido al dolor crónico experimentado antes de la amputación. Esto provoca el dolor del miembro fantasma después de la amputación.
- Cuando se cortan los nervios periféricos durante la amputación, se produce una pérdida de la entrada sensorial de la zona por debajo del nivel de amputación. Esta reducción de las sustancias neuroquímicas altera la vía del dolor en el asta dorsal
- Khan TW, Braun EE. Phantom Limb Pain. Enciclopedia de la atención al trauma. 2015:1235-40.
- Odell R.H., Sorgnard R, Mile R.D., Cary R.M. Novel Treatment Device for Phantom-Limb Pain
Este informe de caso describe el uso de un prometedor y relativamente nuevo dispositivo de tratamiento de señalización de células eléctricas para el dolor del miembro fantasma.
Practical Pain Managment Vol 15 #4. - Clínica Mayo. Dolor del miembro fantasma.
- Coalición de Amputados. Phantom limb pain.
- Finn SB, Perry BN, Clasing JE, Walters LS, Jarzombek SL, Curran S, Rouhanian M, Keszler MS, Hussey-Andersen LK, Weeks SR, Pasquina PF. A randomized, controlled trial of mirror therapy for upper extremity phantom limb pain in male amputees. Fronteras en neurología. 2017 Jul 7;8:267.
- Preißler S, Thielemann D, Dietrich C, Hofmann GO, Miltner WH, Weiss T. Evidencia preliminar de los cambios inducidos por el entrenamiento de la morfología y el dolor del miembro fantasma. Fronteras en la neurociencia humana. 2017 Jun 20;11:319.
- Rothgangel A, Braun S, Witte L, Beurskens A, Smeets R. Desarrollo de un marco clínico para la terapia de espejo en pacientes con dolor de miembro fantasma: un enfoque de práctica basada en la evidencia. Pain Practice (Práctica del dolor). 2016 Apr 1;16(4):422-34.
- Pinto CB, Velez FG, Bolognini N, Crandell D, Merabet LB, Fregni F. Optimización de la rehabilitación para el dolor del miembro fantasma utilizando la terapia de espejo y la estimulación de corriente directa transcraneal: A Randomized, Double-Blind Clinical Trial Study Protocol. Protocolos de investigación JMIR. 2016 Jul;5(3).
- Kikkert S, Mezue M, Slater DH, Johansen-Berg H, Tracey I, Makin TR. Correlatos motores del dolor del miembro fantasma. cortex. 2017 Oct 1;95:29-36.
- Alison Burger The Phantom Limb Accessed from https://www.youtube.com/watch?time_continue=2&v=5BlsoyE1CIw
- Siddle L. El desafío y el manejo del dolor del miembro fantasma después de la amputación. Revista británica de enfermería. 2012;13(11):664-667
- . El dolor después de la amputación. BJA Education. 2016;16(3): 107-112. https://doi.org/10.1093/bjaed/mkv028
- Weinstein, 8th World Congress on Pain, 1996 pg.376
- Jensen TS, Krebs B, Nielsen J, Rasmussen P. Dolor de miembro fantasma inmediato y a largo plazo en amputados: incidencia, características clínicas y relación con el dolor de miembro previo a la amputación. Pain. 1985;21(3):267-78.
- Sherman RA, Sherman CJ. Prevalencia y características del dolor crónico del miembro fantasma entre los veteranos estadounidenses: Resultados de una encuesta de prueba. American Journal of Physical Medicine; Rehabilitation. 1983;62(5):227-38.
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans: results of a survey. Pain. 1984;8(1):83-95.
- 8,0 8,1 8,2 Le Feuvre P, Aldington D. Know Pain Know Gain: proponiendo un enfoque de tratamiento para el dolor del miembro fantasma. J R Army Med Corps. 2014; 160(1):16-21 http://jramc.bmj.com/content/160/1/16.full.pdf+html
- 9.0 9.1 Flor H. Dolor del miembro fantasma: características, causas y tratamiento. Lancet 2002;1:182-9.
- Flor H. Cortical reorganisation and chronic pain; implications for rehabilitation. J Rehabil Med 2003;41:66-72.
- Black LM, Persons RK, Jamieson MLS. Cuál es la mejor manera de manejar el dolor del miembro fantasma? J fam practice 2009;58:155-8.
- Bradbrook D. Tratamiento con acupuntura del dolor del miembro fantasma y de la sensación del miembro fantasma en amputados. Acupunct Med 2004;22:93-7.
- Butler D, Moseley GL. Explicar el dolor. Noigroup Publications, 2010
- 14.0 14.1 Moseley GL. Graded motor imagery for pathologic pain: a randomized controlled trial. Neurología 2006;67:2129-34.
- MacIver K, Lloyd DM, Kelly S, et al. Phantom limb pain, cortical reorganization and the therapeutic effect of mental imagery. Brain 2008;131:2181-91.
- 16.0 16.1 Moseley GL, Gallace A, Spence C. ¿Es la terapia de espejo todo lo que se dice? Evidencia actual y direcciones futuras. Pain. 2008;138:1387-10.
- Neuro Orthopaedic Institute NOI Mirror Box Therapy with David Butler Accessed fromhttps://www.youtube.com/watch?time_continue=1&v=hMBA15Hu35M
- Neuro Orthopaedic Institute NOI What is Graded Motor Imagery Accessed from https://www.youtube.com/watch?time_continue=1&v=fWYUJscRBRw
Sensación fantasma
Las personas con amputación también pueden experimentar sensación fantasma, que es diferente de la PLP. La sensación fantasma es casi universal y no se correlaciona con los informes de dolor. Hay tres tipos de sensación fantasma:
Inicio
El inicio es mayoritariamente inmediato tras la amputación, algunos a las pocas semanas, raramente meses después. Un tercio de los pacientes experimenta los síntomas máximos inmediatamente después de la operación y generalmente se resuelven a los 100 días, la mitad experimenta un dolor que llega lentamente a su punto máximo y mejora a los 100 días, una cuarta parte de los pacientes experimenta un aumento más lento hacia el dolor máximo.
Historia natural
El PLP tiende a disminuir en gravedad y frecuencia con el tiempo, con una resolución de varias semanas a 2 años. Un estudio mostró que el 72% tenía PLP a los 8 días, el 65% a los 6 meses y el 59% a los 2 años. Además, la duración de los episodios varía. Un estudio mostró una PLP continua en el 12%, días 2%, horas 37%, segundos 38%), el 50% tenía una PLP decreciente con el tiempo, el 50% ningún cambio o aumento con el tiempo.
Etiología
Existen numerosas teorías sobre las causas del dolor del miembro fantasma, incluyendo teorías periféricas, centrales y espinales:
Teorías periféricas
Teorías centrales
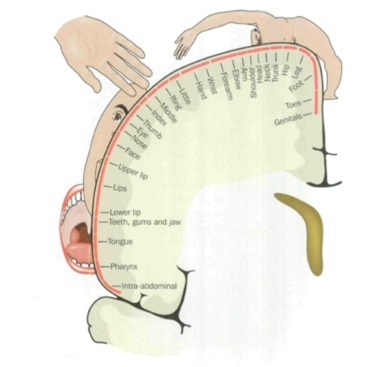
Teorías de la columna vertebral
Motores y opciones de tratamiento
Cuando la PLP está presente, es importante establecer los principales motores. Estos pueden ser la adaptación impulsada centralmente, la sensibilización periférica, el estado mental o las preocupaciones sociales, y los factores musculoesqueléticos. El tratamiento debe dirigirse a estos factores.
| Opciones de tratamiento | Conductores | Adaptación central |
Imágenes mentales (también incluidas dentro de GMI) |
La PLP parece coexistir con una reorganización del mapa cortical. Por ejemplo, en los amputados de las extremidades superiores, cuanto mayor es el desplazamiento de la representación de la boca y la cara hacia la zona de amputación de la mano y el brazo deferentes, mayor es el PLP. La estimulación de los músculos faciales, incluyendo la masticación o los movimientos oculares, provocará entonces el PLP. En las amputaciones de miembros inferiores, este fenómeno puede manifestarse en la migración de las áreas de representación de la vejiga, el intestino y los genitales hacia la zona de amputación. De nuevo, la estimulación de estos órganos provocará el PLP. |
|---|---|---|
| Sensibilización periférica |
Manejo irritante con atención a la exclusión del diagnóstico diferencial, apósitos deficientes, edema del muñón. |
La entrada nociceptiva del muñón parece correlacionarse con el nivel de PLP. El ganglio de la raíz dorsal puede amplificar la descarga del muñón o excitar de forma cruzada las neuronas vecinas. El aumento de la epinefrina circulante resultante de la descarga simpática también desencadenará o exacerbará la actividad neuronal. Dicha descarga simpática puede ser el resultado de la angustia emocional, y también puede deberse a la temperatura o a la inflamación. La estimulación nociceptiva continuada hará que el sistema nervioso periférico sea más eficiente en la transmisión de estas señales y, a su vez, contribuirá a la excitación neuropática. |
| Factores psicológicos y sociales |
Educación |
¿Influye en el dolor el recuerdo del incidente? el recuerdo del dolor previo a la amputación, el estado de ánimo, las preocupaciones sociales o el patrón de sueño? La epinefrina circulante resultante de la angustia emocional puede contribuir a la sensibilización del sistema nervioso periférico. |
| Factores musculoesqueléticos (MSK) |
Mantenimiento del ROM articular/muscular |
La disfunción articular y la derivación MSK pueden contribuir a la presencia de PLP. Además, el uso de prótesis ayuda significativamente a la resolución del PLP, especialmente con el miembro superior. El trabajo preparatorio para garantizar el mantenimiento de la amplitud articular, el movimiento simétrico normal y la estabilización proximal ayudarán a la adaptación protésica y al uso satisfactorio, lo que aumentará potencialmente el efecto beneficioso del uso de la extremidad sobre el PLP. |
Evaluación y toma de decisiones
La imagen siguiente muestra un enfoque de evaluación, que puede ayudar a los clínicos a determinar el curso de acción correcto requerido con un paciente con PLP. La evaluación debe comenzar identificando con precisión que el problema es el PLP. El conocimiento de las diferentes características de cada presentación del dolor ayudará al clínico a establecerlo a partir de la evaluación de su historia:
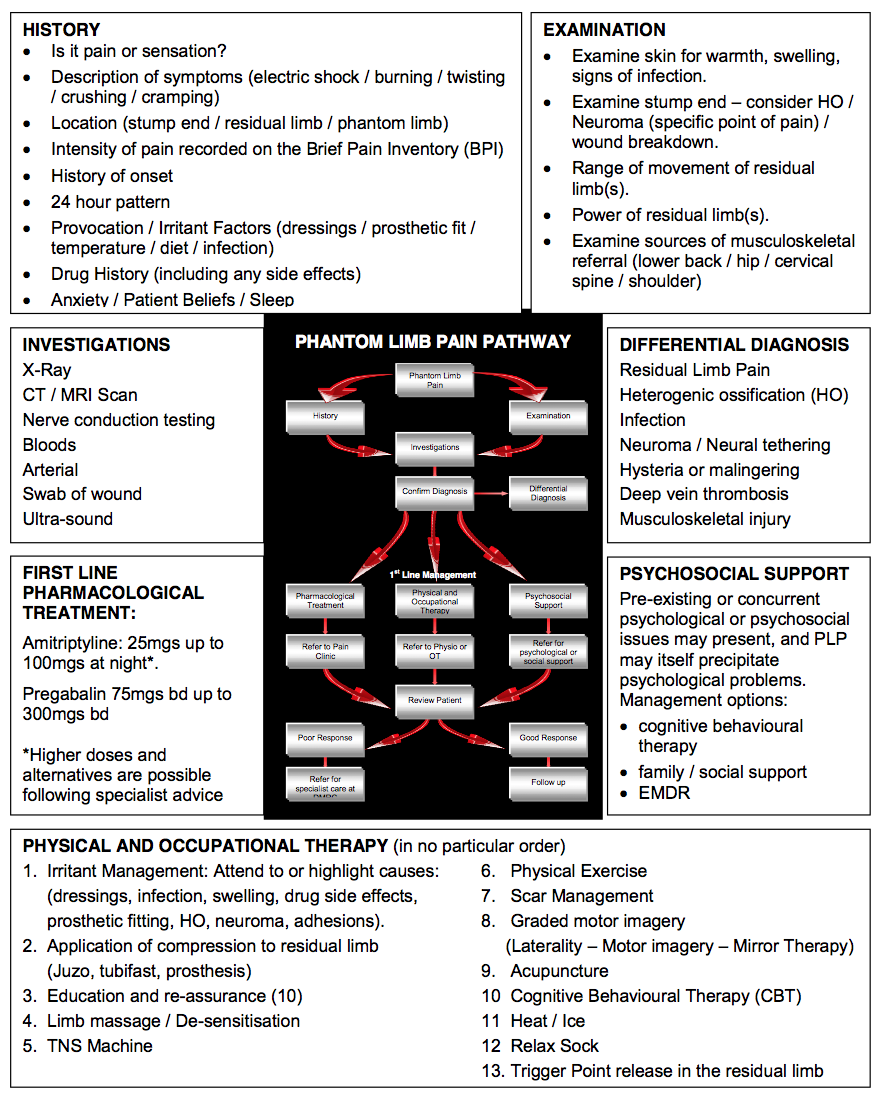
Una ayuda para el razonamiento clínico en el dolor del miembro fantasma
Discriminar entre el dolor del miembro residual (RLP) y el PLP es más complejo de lo que parece. Ambos suelen coexistir y el RLP puede provocar el PLP. Por lo tanto, eliminar las causas del RLP es la prioridad, ya que esto resolverá o disminuirá el PLP, que responde a los agravantes periféricos. También muestra el grado en que los factores centrales pueden tener una influencia continua.
El tratamiento inmediato tras la amputación exige una analgesia efectiva temprana y las medidas complementarias incluyen el manejo del edema mediante calcetines elásticos para el muñón, vendajes semirrígidos y yesos rígidos. El tratamiento posterior a la amputación requiere que se preste atención a las causas intrínsecas y extrínsecas de la RLP.
La RLP extrínseca será el resultado de las complicaciones de la cicatrización de la herida, por lo que debe excluirse la infección. La carga tisular y las fuerzas de corte ejercidas sobre la extremidad debido a un mal ajuste de la prótesis también provocarán dolor. Una revisión protésica mejorará el ajuste y permitirá descargar las estructuras sensibilizadas. La formación de cicatrices también puede causar dolor, especialmente cuando hay atrapamiento de nervios o adherencias que reducen la movilidad de los tejidos blandos. En ambos casos, se recomienda el tratamiento de las cicatrices mediante masajes e hidratación de los tejidos blandos; si es necesario, también se puede añadir un tratamiento con silicona. Además de mejorar la movilidad de los tejidos, el masaje puede utilizarse para desensibilizar el muñón. Las causas intrínsecas de la RLP pueden ser la isquemia, la disfunción articular proximal al muñón, la fractura por estrés, la osteomielitis y la dehiscencia de la herida. Ocasionalmente, cuando el hueso se ha recortado incorrectamente o se ha producido una formación de hueso en el tejido blando extraesquelético, puede producirse dolor en las zonas de alta presión. Se requerirán investigaciones y se puede considerar la cirugía de revisión; alternativamente, se puede utilizar el ajuste protésico para descargar las áreas de presión.
El neuroma es la causa más común de RLP intrínseca. La descarga ectópica puede evocar una respuesta neuropática causando PLP. La formación de neuroma después de la amputación es normal, pero cuando se sensibiliza a los estímulos mecánicos o químicos, a menudo exacerbados por el atrapamiento, se producen problemas. El dolor es intermitente y variable, pero el diagnóstico se confirma por una zona específica de sensibilidad a la palpación, que puede confirmarse con una inyección de anestesia local en la zona. Se puede considerar la derivación quirúrgica, pero el masaje, la vibración, la acupuntura y la estimulación nerviosa eléctrica transcutánea (TENS) también pueden desensibilizar la zona de forma eficaz. También se trabaja excluyendo la tensión/espasmo muscular como causa mediante la evaluación de los puntos locales y gatillo dentro del tejido blando.
Combinar la terapia física y ocupacional con una comprensión cognitiva de la condición amplificará los efectos del tratamiento. Debemos tratar de equipar y empoderar al paciente, informándole sobre su condición y cómo puede tomar el control, al mismo tiempo que tratamos de alterar las creencias y acciones destructivas o erróneas. Las estrategias comunes de autotratamiento pueden incluir el uso de un calcetín elástico para minimizar los cambios de volumen en el muñón, el masaje en el muñón, las imágenes mentales del muñón y la realización de ejercicio físico.
La visualización del movimiento de la extremidad y el uso de la prótesis pueden reducir el PLP, esto es especialmente el caso de los amputados de la extremidad superior. Sin embargo, la disfunción articular próxima al muñón y el ajuste protésico socavan este efecto. Un buen uso de la prótesis es vital. La normalización del patrón de marcha se debe, en parte, al ajuste y la alineación de la prótesis. También depende de una buena propiocepción, un patrón motor correcto y un control simétrico del movimiento que permita la disociación del movimiento entre el tronco y la extremidad. A su vez, el muñón, el tronco y los segmentos de la columna vertebral deben tener una amplitud y un control del movimiento suficientes para lograr un patrón de marcha simétrico. Cuando no sea posible llevar el muñón, el terapeuta debe poner en marcha su creatividad para buscar formas de simular estímulos visuales e incluso motores con el fin de imitar el uso del muñón.
Terapia del espejo
La terapia del espejo es una intervención terapéutica que ha demostrado afectar a los procesos motores y sensoriales a través del dominio relativo de la información visual que proporciona. El efecto se crea al ver un reflejo del miembro intacto, a través de un espejo colocado en el lugar donde habría existido el miembro amputado. La mayor parte de las pruebas de esta intervención proceden de estudios de casos y datos anecdóticos, con sólo un par de estudios bien controlados. Moseley argumentó que, aunque los movimientos en espejo pueden exponer el córtex a la entrada sensorial y motora, el efecto terapéutico se amplía si las redes corticales se activan gradualmente mediante el reconocimiento de la extremidad, la imaginería motora y, finalmente, el movimiento en espejo. Esta secuencia de exposición cortical se conoce como imágenes motoras graduales. Los clínicos que deseen añadir este programa a su repertorio de tratamiento pueden encontrar recursos en NOIGroup
|
|
Una nota sobre la medicación
El sistema militar de manejo del dolor del Reino Unido fomenta el uso de medicación antineurpática como la pregabalina y la amitriptilina lo antes posible. El tratamiento de primera línea es un ensayo de hasta 300 mg dos veces al día de pregabalina y hasta 150 mg de amitriptilina por la noche. Si la pregabalina es insuficiente, o la depresión es un problema, puede utilizarse duloxetina. Los opioides son de ayuda variable. Es posible que el tapentadol resulte beneficioso, pero es demasiado pronto para decirlo con claridad. Aunque los agentes farmacológicos pueden ser útiles, la forma en que se utilizan es aún más importante. Los agentes farmacológicos no van a eliminar todo el dolor. Lo que realmente importa es que los agentes permitan al paciente «hacer más». En este sentido, pueden compararse con el antiguo anuncio de golosinas que sugería que permitían «trabajar, descansar y jugar»; la cuestión es que si los agentes farmacológicos no tienen esta acción, no tiene sentido tomarlos. A menudo, un buen punto de partida es permitir un buen sueño. Siempre se puede tener una buena noche después de un mal día, pero nunca un buen día después de una mala noche.
Recursos
.