
Cuando los médicos miden el cortisol salival y la DHEA (DHEA-S) para evaluar el estrés y la función del eje HPA, es común encontrar niveles de DHEA por debajo del rango de referencia en un número de individuos. Una explicación común para el agotamiento de la DHEA y otras hormonas (por ejemplo, progesterona, testosterona) debido al estrés crónico es el fenómeno conocido como «robo de pregnenolona.»
La noción de robo de pregnenolona afirma que, dado que todas las hormonas esteroides utilizan la pregnenolona (derivada del colesterol) como precursor, la elevada secreción de cortisol causada por el estrés agudo o crónico dará lugar inevitablemente a una menor disponibilidad de pregnenolona que sirva como precursor para la producción de DHEA y otras hormonas de flujo descendente.
En otras palabras, según esta teoría, la necesidad de la síntesis de cortisol «roba» pregnenolona de otras vías hormonales, reduciendo la síntesis y secreción potencial de otras hormonas necesarias, dando lugar a algunos de los cambios fisiopatológicos relacionados con el estrés. Mientras que un aumento de los niveles de cortisol y un descenso concomitante de la DHEA es una de las características clínicas de la progresión del estrés crónico en su fase inicial y media, este fenómeno no está causado por la disminución de la disponibilidad de pregnenolona suprarrenal o el «robo de pregnenolona». La razón más obvia es el hecho de que la conversión de colesterol en pregnenolona se produce en las mitocondrias de cada tipo de célula de la corteza suprarrenal respectiva que se encarga de producir estas hormonas.
Simplemente, no se conoce ninguna reserva suprarrenal de pregnenolona para que una célula la robe a otra, y no se ha descrito ningún mecanismo conocido que pueda facilitar la transferencia de pregnenolona entre las mitocondrias de diferentes células (en este caso, desde las mitocondrias de las células de la zona reticularis a las de la zona fasciculata). Desgraciadamente, las figuras más comunes utilizadas para enseñar la esteroidogénesis muestran una vía común y normalmente no especifican la regulación diferencial de las enzimas disponibles entre los distintos tejidos esteroidogénicos. Esto lleva a muchos a asumir incorrectamente que hay un único «pool» de pregnenolona disponible para toda la síntesis de hormonas esteroides dentro de la suprarrenal. Una manera mucho mejor de enseñar esto es mostrar las diferentes enzimas disponibles para cada célula dentro de la corteza suprarrenal, mostrando que cada una es capaz de convertir el colesterol en pregnenolona; luego en las diversas hormonas necesarias. La siguiente figura es un extracto de The Standard Road Map, The Role of Stress and the HPA Axis in Chronic Disease Management. Demuestra una mejor manera de enseñar este concepto, una que evita mostrar un único «pool» de pregnenolona para todas las hormonas del flujo descendente.
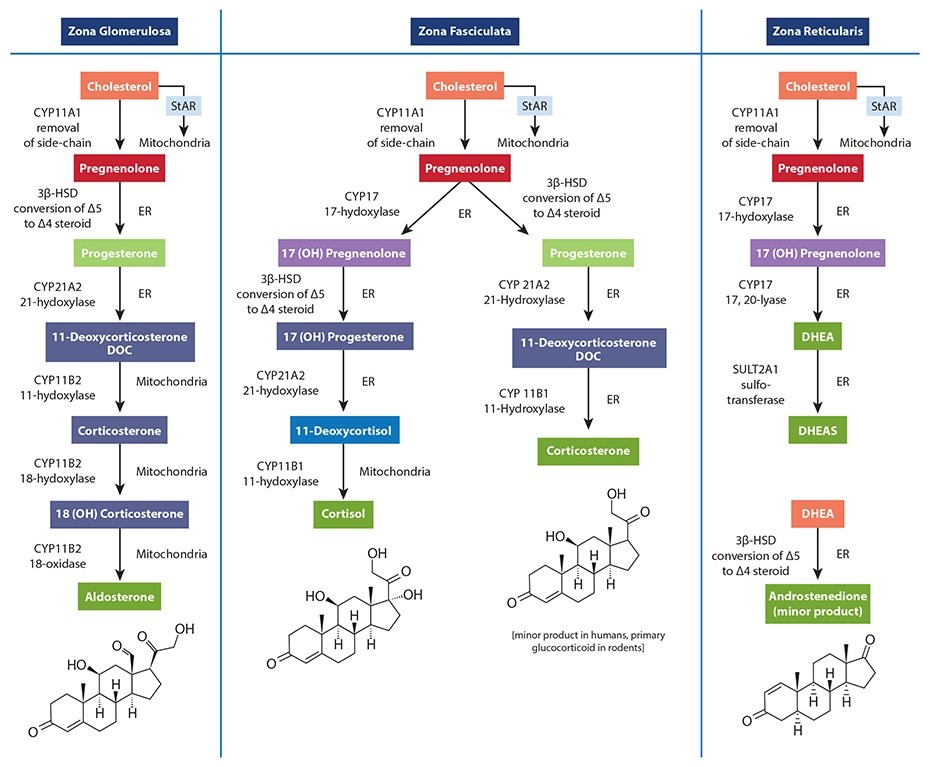
Además, la síntesis suprarrenal de cortisol impulsada por la ACTH es órdenes de magnitud superiores a la de la DHEA, y fluctúa radicalmente en un período de 24 horas. Si hubiera una «reserva de pregnenolona» suprarrenal que contuviera suficientes precursores de pregnenolona para la producción elevada de cortisol por la mañana (o durante el estrés), esta «reserva» también estaría disponible para la cantidad mucho más pequeña de producción de DHEA necesaria cuando la síntesis de cortisol disminuye incluso un poco.
La investigación ha demostrado que el control de la producción de hormonas suprarrenales está regulado principalmente por las concentraciones de enzimas específicas de la célula y las señales externas procedentes de fuera de la glándula suprarrenal.
Finalmente, como décadas de investigación de la esteroidogénesis han demostrado, el control de la producción de hormonas suprarrenales está regulado principalmente por las concentraciones de enzimas específicas de la célula y las señales externas procedentes de fuera de la glándula suprarrenal (Ver nuestro último libro para más detalles). ¿Qué significa esto en relación con la producción de cortisol y DHEA que, cuando se mide, parece confirmar este fenómeno? ¿Qué pasa con el papel de la terapia oral de pregnenolona para apoyar la producción suprarrenal de DHEA? Bueno, es un poco complicado. Mientras que el estrés del eje HPA y la subsiguiente síntesis y secreción de cortisol pueden estar relacionados con la aceleración de la reducción de la producción de DHEA (es decir, una regulación a la baja de la DHEA inducida por el estrés), esta relación se ve facilitada por los procesos de regulación (por ejemplo, las inhibiciones de retroalimentación, la señalización de los receptores, la regulación genómica de las enzimas, etc.), y no por un agotamiento intra-adrenal de la pregnenolona como precursor de las hormonas descendentes. Por ejemplo, se ha demostrado que la hiperglucemia y la hiperinsulinemia inducidas experimentalmente afectan a la producción de DHEA y androstenediona en sujetos humanos.
En un estudio de sujetos diabéticos de tipo 2 mal controlados con cortisol elevado y niveles bajos de DHEA, se demostró que la enzima necesaria para la formación de DHEA en la zona reticularis (17,20 liasa) limitaba la producción de DHEA. La actividad de la enzima se corrigió (junto con la casi normalización de los niveles de cortisol, DHEA y DHEA-S) tras seis meses de dieta o farmacoterapia para mejorar el control de la glucemia. Además, los estudios de cultivo de células sugieren que bajo estrés inflamatorio (IL-4 y otras citoquinas), la zona reticularis regulará a la baja la producción de DHEA cuando la ACTH esté presente. Estos y muchos otros factores (por ejemplo, el envejecimiento) son probablemente las influencias que afectan a la relación dinámica entre el cortisol (activado por el eje HPA) y los niveles medidos de DHEA y/o DHEA-S. Al reevaluar los mecanismos específicos que impulsan los cambios relacionados con el estrés en la producción de hormonas suprarrenales, y alejarse de las explicaciones más antiguas e incorrectas, podemos buscar (y tal vez abordar) las diversas señales que son realmente responsables de la modulación de la secreción de hormonas suprarrenales durante la progresión del estrés crónico.
Si está interesado en aprender más sobre este tema y sobre cómo la pregnenolona y la DHEA orales pueden mejorar los resultados en sujetos con disfunciones relacionadas con el estrés, considere la posibilidad de adquirir El papel del estrés y el eje HPA en el manejo de las enfermedades crónicas.
Recursos relacionados
- Blog: ¿Es la fatiga suprarrenal? Reevaluando la nomenclatura de la disfunción del eje HPA.
- Blog: Cómo utilizar la Respuesta de Despertar del Cortisol (CAR) en el abordaje de la función suprarrenal
- Blog: Fluctuaciones diurnas de norepinefrina & Epinefrina como parte de la respuesta al estrés de la salud
Boudou P, Sobngwi E, Ibrahim F et al. La hiperglucemia disminuye de forma aguda los niveles circulantes de dehidroepiandrosterona en hombres sanos. Clin Endocrinol (Oxf). 2006 Jan;64(1):46-52.
Vásárhelyi B, Bencsik P, Treszl A, et al. The effect of physiologic hyperinsulinemia during an oral glucose tolerance test on the levels of dehydroepiandrosterone (DHEA) and its sulfate (DHEAS) in healthy young adults born with low and with normal birth weight. Endocr J. 2003 Dec;50(6):689-95.
Ueshiba H, Shimizu Y, Hiroi N et al. Disminución de la enzima esteroidogénica 17,20-liasa y aumento de las actividades de la 17-hidroxilasa en la diabetes mellitus tipo 2. Eur J Endocrinol. 2002 Mar;146(3):375-80.
Woods AM, Judd AM. La interleucina-4 aumenta la liberación de cortisol y disminuye la liberación de andrógenos suprarrenales de las células suprarrenales bovinas. Domest Anim Endocrinol. 2008 May;34(4):372-82.
Woods AM, McIlmoil CJ, Rankin EN. Et al. La proteína del factor inhibidor de la leucemia y los receptores se expresan en la corteza suprarrenal bovina y aumentan el cortisol y disminuyen la liberación de andrógenos suprarrenales. Domest Anim Endocrinol. 2008 Aug;35(2):217-30.