| Atributo de geometría | α-hélice | 310 hélice | π-hélice |
|---|---|---|---|
| Residuos por vuelta | 3.6 | 3,0 | 4,4 | Translación por residuo | 1,5 Å (0,15 nm) | 2,0 Å (0,20 nm) | 1,1 Å (0,11 nm) | Radio de la hélice | 2.3 Å (0,23 nm) | 1,9 Å (0,19 nm) | 2,8 Å (0,28 nm) |
| Pitch | 5,4 Å (0,54 nm) | 6,0 Å (0,60 nm) | 4,8 Å (0.48 nm) |
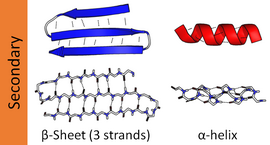
Las estructuras secundarias más comunes son las hélices alfa y las hojas beta. Otras hélices, como la hélice 310 y la hélice π, se calculan para tener patrones de enlace de hidrógeno energéticamente favorables, pero rara vez se observan en las proteínas naturales, excepto en los extremos de las hélices α, debido al empaquetamiento desfavorable de la columna vertebral en el centro de la hélice. Otras estructuras extendidas, como la hélice de poliprolina y la hoja alfa, son raras en las proteínas en estado nativo, pero a menudo se consideran intermediarios importantes en el plegamiento de las proteínas. Los giros estrechos y los bucles flexibles y sueltos unen los elementos más «regulares» de la estructura secundaria. El espiral aleatorio no es una verdadera estructura secundaria, sino que es la clase de conformaciones que indican una ausencia de estructura secundaria regular.
Los aminoácidos varían en su capacidad para formar los distintos elementos de estructura secundaria. La prolina y la glicina se conocen a veces como «rompedores de hélices» porque interrumpen la regularidad de la conformación de la espina dorsal α helicoidal; sin embargo, ambos tienen capacidades conformacionales inusuales y se encuentran comúnmente en giros. Entre los aminoácidos que prefieren adoptar conformaciones helicoidales en las proteínas se encuentran la metionina, la alanina, la leucina, el glutamato y la lisina («MALEK» en los códigos de 1 letra de los aminoácidos); por el contrario, los grandes residuos aromáticos (triptófano, tirosina y fenilalanina) y los aminoácidos de cadena Cβ (isoleucina, valina y treonina) prefieren adoptar conformaciones de cadena β. Sin embargo, estas preferencias no son lo suficientemente fuertes como para producir un método fiable de predicción de la estructura secundaria a partir de la secuencia sola.
Se cree que las vibraciones colectivas de baja frecuencia son sensibles a la rigidez local dentro de las proteínas, revelando que las estructuras beta son genéricamente más rígidas que las proteínas alfa o desordenadas. Las mediciones de dispersión de neutrones han conectado directamente la característica espectral a ~1 THz con los movimientos colectivos de la estructura secundaria de la proteína beta-barril GFP.
Los patrones de enlace de hidrógeno en las estructuras secundarias pueden estar significativamente distorsionados, lo que dificulta la determinación automática de la estructura secundaria. Existen varios métodos para definir formalmente la estructura secundaria de las proteínas (por ejemplo, DSSP, DEFINE, STRIDE, ScrewFit, SST).
Clasificación DSSPEdit

El Diccionario de Estructura Secundaria de Proteínas, abreviado DSSP, se utiliza habitualmente para describir la estructura secundaria de las proteínas con códigos de una sola letra. La estructura secundaria se asigna basándose en los patrones de enlace de hidrógeno, como los propuestos inicialmente por Pauling et al. en 1951 (antes de que se determinara experimentalmente ninguna estructura proteica). Hay ocho tipos de estructura secundaria que DSSP define:
- G = hélice de 3 vueltas (310 hélice). Longitud mínima 3 residuos.
- H = hélice de 4 vueltas (hélice α). Longitud mínima 4 residuos.
- I = hélice de 5 vueltas (π hélice). Longitud mínima 5 residuos.
- T = giro con enlace de hidrógeno (3, 4 o 5 giros)
- E = hebra extendida en conformación de hoja β paralela y/o antiparalela. Longitud mínima de 2 residuos.
- B = residuo en puente β aislado (formación de enlace de hidrógeno de un solo par de β-hoja)
- S = curva (la única asignación no basada en enlaces de hidrógeno).
- C = bobina (residuos que no están en ninguna de las conformaciones anteriores).
- E = Hebra (extendida) de una hoja β-plegada
- G = Hélice 310 derecha
- H = Hélice α derecha
- I = Hélice π derecha
- g = Hélice 310 izquierda
- h = Hélice α izquierdahanded α-helix
- i = Left-handed π-helix
- 3 = 310-like Turn
- 4 = α-like Turn
- 5 = π-like Turn
- T = Unspecified Turn
- C = Coil
- – = Unassigned residue
La ‘bobina’ se codifica a menudo como ‘ ‘ (espacio), C (bobina) o ‘-‘ (guión). Se requiere que las conformaciones de hélice (G, H e I) y de hoja tengan una longitud razonable. Esto significa que 2 residuos adyacentes en la estructura primaria deben formar el mismo patrón de enlace de hidrógeno. Si el patrón de enlace de hidrógeno de la hélice o de la hoja es demasiado corto, se designan como T o B, respectivamente. Existen otras categorías de asignación de estructuras secundarias de proteínas (giros bruscos, bucles Omega, etc.), pero se utilizan con menos frecuencia.
La estructura secundaria se define por el enlace de hidrógeno, por lo que la definición exacta de un enlace de hidrógeno es crítica. La definición estándar de enlace de hidrógeno para la estructura secundaria es la de DSSP, que es un modelo puramente electrostático. Asigna cargas de ±q1 ≈ 0,42e al carbono carbonilo y al oxígeno, respectivamente, y cargas de ±q2 ≈ 0,20e al hidrógeno amida y al nitrógeno, respectivamente. La energía electrostática es
E = q 1 q 2 ( 1 r O N + 1 r C H – 1 r O H – 1 r C N ) ⋅ 332 kcal/mol . {\displaystyle E=q_{1}q_{2} {\frac {1}{r_{mathrm {ON}} }}+{{frac {1}{r_{mathrm {CH}} {{frac {1}{r_{mathrm {OH}}-{frac {1}{r_{mathrm {OH}} {{frac {1}{r_{mathrm}{CN}}-{frac {1}{r_{mathrm}{CN}} derecha) 332 kcal/mol.

Clasificación SSTEditar
SST es un método bayesiano para asignar la estructura secundaria a los datos de coordenadas de la proteína utilizando el criterio de información de Shannon de la inferencia de la longitud mínima del mensaje (MML). SST trata cualquier asignación de estructura secundaria como una hipótesis potencial que intenta explicar (comprimir) unos datos de coordenadas de proteínas dados. La idea central es que la mejor asignación de estructura secundaria es la que puede explicar (comprimir) las coordenadas de una proteína dada de la manera más económica, vinculando así la inferencia de la estructura secundaria a la compresión de datos sin pérdidas. SST delimita con precisión cualquier cadena de proteínas en regiones asociadas a los siguientes tipos de asignación: