Pourquoi les réactions se déroulent-elles à des vitesses différentes ? Pourquoi certaines se produisent-elles rapidement, et d’autres très lentement ? Pourquoi la même réaction peut-elle se dérouler à des vitesses différentes dans des conditions différentes ? Il existe un certain nombre de facteurs qui influencent les vitesses de réaction, mais cet article se concentre sur la barrière d’activation.
Une barrière d’activation est une sorte d’obstacle énergétique qu’une réaction doit contourner. Certaines réactions ont des obstacles plus élevés et d’autres des obstacles plus faibles. Il est plus facile de franchir les obstacles inférieurs, de sorte que les réactions avec des barrières d’activation faibles peuvent se dérouler plus rapidement que celles avec des barrières d’activation plus élevées :
- Une barrière d’activation faible permet à une réaction de se produire rapidement.
- Une barrière d’activation élevée fait en sorte qu’une réaction se déroule plus lentement.
Une réaction peut être globalement exergonique, mais avoir une barrière d’activation au début. Même si le système diminue en énergie à la fin de la réaction, il connaît généralement une augmentation initiale de l’énergie.
-
Même si une réaction dégage globalement de l’énergie, de l’énergie doit être ajoutée initialement pour que la réaction démarre.
Cette situation est similaire à l’investissement dans une entreprise. Une entreprise nécessite généralement un investissement financier pour démarrer. Si l’entreprise réussit, elle finira par fabriquer des produits et rembourser les investisseurs. Si l’entreprise n’est pas en mesure de rembourser son investissement initial, elle peut faire faillite.
Les réactions nécessitent un investissement initial d’énergie. Cette énergie peut provenir des molécules environnantes ou de l’environnement en général. Si la réaction est réussie, elle procédera à la fabrication de produits et elle émettra de l’énergie en retour vers son environnement.
- Il » coûte » toujours de l’énergie à une molécule pour entrer dans une réaction ; elle » emprunte » cette énergie à son environnement.
- Cet investissement initial d’énergie peut être » remboursé » au fur et à mesure que la réaction se déroule.
Toutes les réactions doivent surmonter des barrières d’activation pour se produire. La barrière d’activation est la somme de l’énergie qui doit être dépensée pour que la réaction se produise. Une barrière d’activation est souvent représentée comme une colline que les réactifs doivent franchir pendant la réaction. Une fois là, ils peuvent glisser de l’autre côté de la colline pour devenir des produits. Au sommet de la colline, la molécule existe dans ce qu’on appelle « l’état de transition ». À l’état de transition, la structure se situe quelque part entre sa forme originale et la structure des produits.
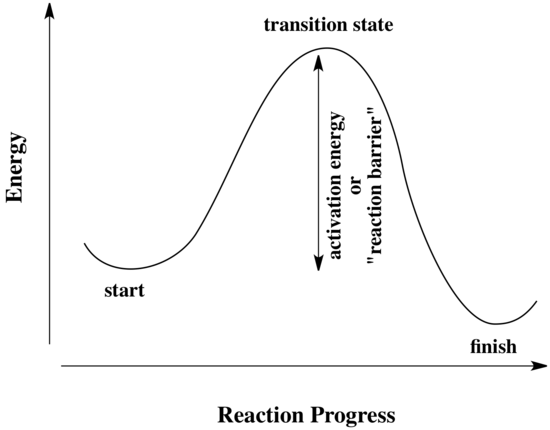
Le type de diagramme présenté ci-dessus est parfois appelé « diagramme de progression de la réaction ». Il montre les changements d’énergie dans le système au fur et à mesure qu’une réaction se déroule. Une ou plusieurs barrières d’activation peuvent exister le long des voies de réaction, en raison de diverses étapes élémentaires de la réaction.
Pour comprendre plus concrètement les termes » déroulement de la réaction » et » état de transition « , considérez une réaction réelle. Supposons qu’un nucléophile, tel qu’un ion acétylure, donne ses électrons à un carbonyle électrophile. La liaison π se rompt et un ion alcoxyde est formé.

L’expression « avancement de la réaction » désigne le degré d’avancement de la réaction. L’état de transition fait spécifiquement référence au point d’énergie le plus élevé sur le chemin qui mène des réactifs aux produits. Il fait référence à la structure à ce point, et à l’énergie associée à cette structure.
Dans le diagramme suivant, le terme « avancement de la réaction » a été remplacé par une illustration qui fait correspondre l’état de la réaction avec le point correspondant de la courbe d’énergie. La structure entre les crochets est l’état de transition, correspondant au maximum de la courbe. Le symbole de la « double dague » indique une structure d’état de transition.
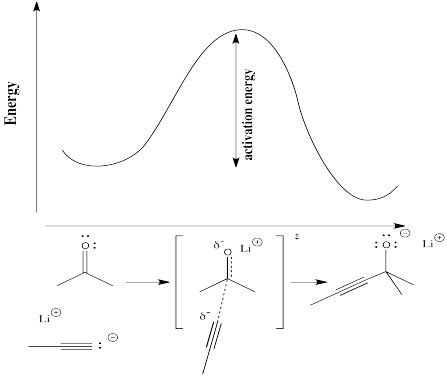
L’état de transition n’est pas une véritable structure chimique. Il n’obéit pas nécessairement aux règles des structures de Lewis, car certaines nouvelles liaisons ont commencé à se former et certaines anciennes liaisons ont commencé à se rompre ; les liaisons partielles n’ont pas leur place dans une structure de Lewis.
Physiquement, la structure de l’état de transition ne peut pas être isolée. Parce qu’il se trouve au sommet d’une courbe d’énergie, l’état de transition a tendance à se convertir en autre chose. Un changement dans l’une ou l’autre direction fera baisser son énergie. La tendance est de se diriger vers l’énergie la plus basse si possible. Dès que l’état de transition se forme, il va soit glisser vers les matériaux de départ originaux, soit glisser vers les produits finaux.
-
L’état de transition est par nature une structure instable à haute énergie, dont la durée de vie est très courte. Dès qu’il est formé, il disparaît.
Contributeurs et attributions
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
.