Les liaisons sigma et pi
Le modèle d’hybridation permet d’expliquer les molécules comportant des liaisons doubles ou triples (voir figure ci-dessous). L’éthène \(\left( \ce{C_2H_4} \right)\) contient une double liaison covalente entre les deux atomes de carbone et des liaisons simples entre les atomes de carbone et les atomes d’hydrogène. La molécule entière est plane.
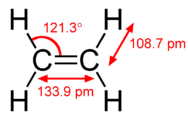
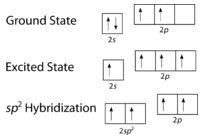
Comme on peut le voir sur la figure ci-dessous, la géométrie du domaine électronique autour de chaque carbone indépendamment est trigonal plan. Cela correspond à une hybridation \(sp^2\). Nous avons vu précédemment que le carbone subissait une hybridation \(sp^3\) dans une molécule \(\ce{CH_4}\), la promotion électronique est donc la même pour l’éthène, mais l’hybridation se produit uniquement entre l’unique orbitale \(s\) et deux des trois orbitales \(p\). Cela génère donc un ensemble de trois hybrides \(sp^2\) ainsi qu’une orbitale \(2p_z\) non hybridée. Chacune contient un électron et est donc capable de former une liaison covalente.
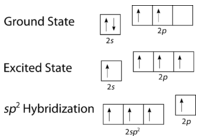
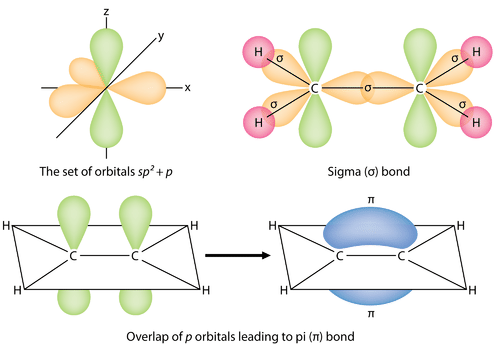
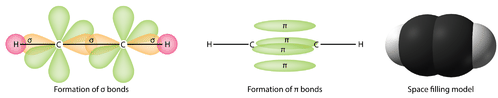
Les trois orbitales hybrides \(sp^2\) se trouvent dans un plan, tandis que l’orbitale non hybridée \(2p_z\) est orientée perpendiculairement à ce plan. La liaison dans l’\(\ce{C_2H_4}\) s’explique comme suit. L’un des trois hybrides \(sp^2\) forme une liaison en chevauchant l’orbitale hybride identique sur l’autre atome de carbone. Les deux autres orbitales hybrides forment des liaisons en se chevauchant avec l’orbitale \(1s\) d’un atome d’hydrogène. Enfin, les orbitales \(2p_z\) de chaque atome de carbone forment une autre liaison en se chevauchant latéralement.
Il est nécessaire de distinguer les deux types de liaisons covalentes dans une molécule \(\ce{C_2H_4}\). Une liaison sigma (\(\sigma\)) est une liaison formée par le chevauchement des orbitales de manière bout à bout, la densité électronique étant concentrée entre les noyaux des atomes liants. Une liaison pi (\(\pi\)) est une liaison formée par le chevauchement d’orbitales côte à côte, la densité électronique étant concentrée au-dessus et au-dessous du plan des noyaux des atomes qui se lient. La figure ci-dessous illustre les deux types de liaison dans la molécule \(\ce{C_2H_4}\). Les orbitales hybrides \(sp^2\) sont violettes et l’orbitale \(p_z\) est bleue. Trois liaisons sigma sont formées à partir de chaque atome de carbone pour un total de six liaisons sigma dans la molécule. La liaison pi est la » deuxième » liaison des doubles liaisons entre les atomes de carbone et est représentée par un lobe vert allongé qui s’étend à la fois au-dessus et au-dessous du plan de la molécule. Ce plan contient les six atomes et toutes les liaisons sigma.
Dans une structure de Lewis conventionnelle à points d’électrons, une double liaison est représentée par un double tiret entre les atomes comme dans \(\ce{C=C}\). Il est cependant important de réaliser que les deux liaisons sont différentes : l’une est une liaison sigma, tandis que l’autre est une liaison pi.
L’éthyne \(\left( \ce{C_2H_2} \right)\) est une molécule linéaire avec une triple liaison entre les deux atomes de carbone (voir la figure ci-dessous). L’hybridation est donc \(sp\).
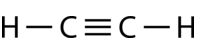
La promotion d’un électron dans l’atome de carbone se produit de la même manière. Cependant, l’hybridation ne concerne plus que l’orbitale \(2s\) et l’orbitale \(2p_x\), laissant les orbitales \(2p_y\) et \(2p_z\) non hybridées.
Les orbitales hybrides \(sp\) forment une liaison sigma entre elles ainsi que des liaisons sigma avec les atomes d’hydrogène. Les orbitales \(p_y\) et \(p_z\) de chaque atome de carbone forment des liaisons pi entre elles. Comme pour l’éthène, ces chevauchements latéraux sont au-dessus et au-dessous du plan de la molécule. L’orientation des deux liaisons pi est qu’elles sont perpendiculaires l’une à l’autre (voir figure ci-dessous). Une liaison pi se trouve au-dessus et au-dessous de la ligne de la molécule, comme indiqué, tandis que l’autre se trouve devant et derrière la page.
En général, les liaisons simples entre atomes sont toujours des liaisons sigma. Les liaisons doubles sont constituées d’une liaison sigma et d’une liaison pi. Les liaisons triples sont constituées d’une liaison sigma et de deux liaisons pi.
.