Rédacteur original – Peter Le Feuvre dans le cadre du Réseau mondial de physiothérapie pour le projet de réadaptation des amputés
Principaux contributeurs – Tony Lowe, Tarina van der Stockt, Kim Jackson, Uchechukwu Chukwuemeka et Vidya Acharya
Introduction
La douleur du membre fantôme (PLP) est définie comme « une douleur localisée dans la région de la partie du corps enlevée » . C’est un phénomène clinique mal compris qui reste le sujet d’intenses recherches en raison de la nature aiguë et chronique de l’affection. L’incidence atteindrait 60 à 80 % chez les patients post-amputation et les facteurs de risque incluent la douleur chronique pré-amputation, la douleur chirurgicale post-opératoire et la détresse psychologique.
- Douleurs fantômes souvent décrites comme un écrasement, une torsion des orteils, un fer chaud, une brûlure, des picotements, des crampes, des chocs, des tirs, des « aiguilles & »
- Tend à se localiser aux structures fantômes plus distales (par ex. doigts et orteils)
- Prévalence aux stades précoces 60-80%
- Indépendante de l’âge chez les adultes, du sexe, du niveau ou du côté de l’amputation
Sensation fantôme
Les personnes amputées peuvent également ressentir une sensation fantôme, qui est différente de la PLP. La sensation fantôme est presque universelle et n’est pas en corrélation avec les rapports de douleur. Il existe trois types de sensations fantômes :
- Kinétiques (mouvement)
- Kinesthésiques (taille, forme, position)
- Extéroceptives (toucher, pression, température, démangeaison, vibration)
Début
Le début est le plus souvent immédiat après l’amputation, certains à quelques semaines, rarement des mois plus tard. Un tiers des patients éprouvent des symptômes maximaux immédiatement après l’opération et généralement résolus au bout de 100 jours, une moitié éprouve une douleur qui atteint lentement un pic et s’améliore au bout de 100 jours, un quart des patients connaissent une montée plus lente vers la douleur maximale.
Histoire naturelle
La PLP tend à diminuer en gravité et en fréquence avec le temps, avec une résolution sur plusieurs semaines à 2 ans. Une étude a montré que 72% avaient une PLP à 8 jours, 65% à 6 mois, 59% à 2 ans. La durée des épisodes est également variable. Une étude a montré une PLP continue en 12%, jours 2%, heures 37%, secondes 38%), 50% avaient une PLP décroissante avec le temps, 50% aucun changement ou augmentation avec le temps.
Alétiologie
Il existe de nombreuses théories sur les causes de la douleur du membre fantôme, notamment des théories périphériques, centrales et spinales :
Théories périphériques
- Les nerfs restants dans le moignon se développent pour former des névromes, qui génèrent des impulsions. Ces impulsions sont perçues comme une douleur dans le membre qui a été enlevé.
- Après que des changements dans la sévérité de la douleur du membre fantôme aient été notés à différentes températures, une autre théorie dit que le refroidissement des terminaisons nerveuses augmente le taux de tir des impulsions nerveuses, qui sont perçues par le patient comme une douleur du membre fantôme
Théories centrales
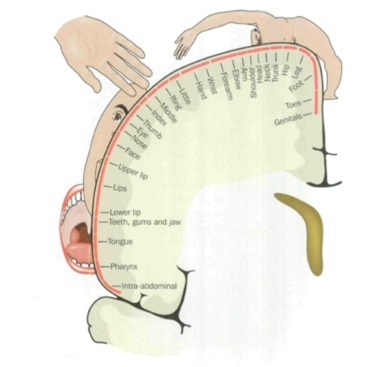
- Melzack a proposé que le corps soit représenté dans le cerveau par une matrice de neurones. Les expériences sensorielles créent une neuromatrice unique, qui s’imprime dans le cerveau. Lorsque le membre est retiré, la neuromatrice tente de se réorganiser, mais la neurosignature demeure en raison de la douleur chronique ressentie avant l’amputation. Cela provoque la douleur du membre fantôme après l’amputation.
Théories spinales
- Lorsque les nerfs périphériques sont coupés lors de l’amputation, il y a une perte d’entrée sensorielle de la zone située sous le niveau de l’amputation. Cette réduction des substances neurochimiques modifie la voie de la douleur dans la corne dorsale
Moteurs et options de traitement
Lorsque la PLP est présente, il est important d’établir le ou les principaux moteurs. Il peut s’agir d’une adaptation d’origine centrale, d’une sensibilisation périphérique, d’un état mental ou de préoccupations sociales, et de facteurs musculo-squelettiques. Le traitement doit cibler ces moteurs.
| Options de traitement | Moteurs | |
|---|---|---|
|
. Adaptation centrale
|
Imagerie mentale (également incluse dans la GMI) |
La PLP semble coexister avec une réorganisation de la carte corticale. Par exemple, chez les amputés des membres supérieurs, plus le déplacement de la représentation de la bouche et du visage dans la zone désafférenciée de l’amputation de la main et du bras est important, plus la PLP est importante. La stimulation des muscles faciaux, y compris la mastication ou les mouvements des yeux, déclenchera alors la PLP. Dans les amputations des membres inférieurs, ce phénomène peut se manifester par la migration des zones de représentation de la vessie, des intestins et des organes génitaux dans la zone d’amputation. Là encore, la stimulation de ces organes déclenchera la PLP. |
| Sensibilisation périphérique |
Prise en charge irritative en veillant à exclure le diagnostic différentiel, mauvais pansements, œdème du moignon. |
L’entrée nociceptive du membre résiduel semble être en corrélation avec le niveau de PLP. Le ganglion de la racine dorsale peut amplifier la décharge du membre résiduel ou provoquer une excitation croisée des neurones voisins. L’augmentation de l’épinéphrine circulante résultant de la décharge sympathique déclenchera ou exacerbera également l’activité neuronale. Cette décharge sympathique peut résulter d’une détresse émotionnelle, mais peut aussi être due à la température ou à une inflammation. Une stimulation nociceptive continue fera en sorte que le système nerveux périphérique devienne plus efficace pour transmettre ces signaux et contribuera à son tour à l’excitation neuropathique. |
Facteurs psychologiques et sociaux |
Éducation |
La douleur est-elle influencée par la mémoire de l’incident, le souvenir de la douleur procédant à l’amputation, l’état d’humeur, les préoccupations sociales ou le rythme de sommeil ? L’épinéphrine circulante résultant de la détresse émotionnelle peut contribuer à la sensibilisation du système nerveux périphérique. |
Facteurs musculo-squelettiques (MSK) |
L’ROM articulaire/musculaire |
Dysfonctionnement articulaire et orientation MSK peuvent contribuer à la présence de PLP. De plus, l’utilisation d’une prothèse aide considérablement à la résolution de la PLP, en particulier au niveau du membre supérieur. Le travail préparatoire visant à assurer le maintien de l’amplitude articulaire, du mouvement symétrique normal et de la stabilisation proximale facilitera l’adaptation de la prothèse et son utilisation réussie, ce qui renforcera potentiellement l’effet bénéfique du port du membre sur la PLP. |
Évaluation et prise de décision
L’image ci-dessous montre une approche d’évaluation, qui peut aider les cliniciens à déterminer la bonne marche à suivre avec un patient atteint de PLP. L’évaluation doit commencer par l’identification précise que la PLP est bien le problème. La connaissance des différentes caractéristiques de chaque présentation de la douleur aidera le clinicien à l’établir à partir d’une évaluation de son histoire :
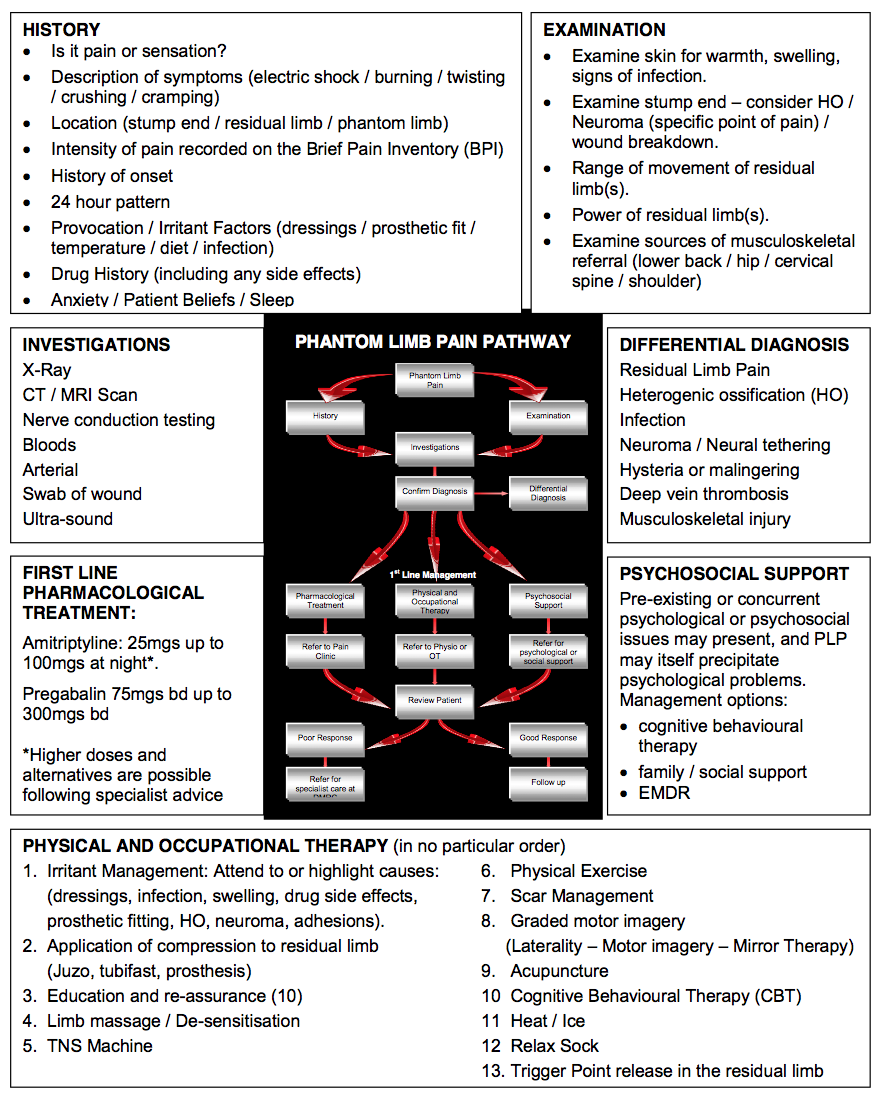
.
Une aide au raisonnement clinique dans la douleur du membre fantôme
La simple discrimination entre la douleur du membre résiduel (RLP) et la PLP est plus complexe qu’il n’y paraît. Les deux coexistent souvent et la RLP peut provoquer la PLP. L’élimination des causes de la DML est donc la priorité car elle permettra de résoudre ou d’atténuer la DPP qui répond à des facteurs d’aggravation périphériques. Cela montre également à quel point les facteurs centraux peuvent avoir une influence permanente.
La prise en charge post-amputation immédiate exige une analgésie précoce efficace et les mesures adjuvantes comprennent la gestion de l’œdème à l’aide de chaussettes élastiques pour moignon, de pansements semi-rigides et de plâtres rigides. La gestion post-aiguë nécessite une attention aux causes intrinsèques et extrinsèques de la RLP.
La RLP extrinsèque résultera de complications de la cicatrisation de la plaie et l’infection doit donc être exclue. La charge tissulaire et les forces de cisaillement exercées sur le membre en raison d’un mauvais ajustement prothétique évoqueront également la douleur. Une révision de la prothèse améliorera l’ajustement et permettra de décharger les structures sensibilisées. La formation de cicatrices peut également être à l’origine de douleurs, notamment en cas de piégeage nerveux ou d’adhérences réduisant la mobilité des tissus mous. Dans les deux cas, il est recommandé de gérer les cicatrices par des massages des tissus mous et une crème hydratante ; un traitement au silicone peut également être ajouté si nécessaire. En plus d’améliorer la mobilité des tissus, le massage peut être utilisé pour désensibiliser le membre résiduel. Les causes intrinsèques de la RLP peuvent inclure l’ischémie, le dysfonctionnement de l’articulation proximale du membre résiduel, la fracture de stress, l’ostéomyélite et la déhiscence de la plaie. Parfois, lorsque l’os a été mal taillé ou qu’il y a eu formation d’os dans les tissus mous extra-squelettiques, des douleurs peuvent apparaître dans les zones de forte pression. Des investigations seront nécessaires et une chirurgie de révision peut être envisagée ; alternativement, un ajustement prothétique peut être utilisé pour décharger les zones de pression.
Le neurinome est la cause la plus fréquente de RLP intrinsèque. Une décharge ectopique peut évoquer une réponse neuropathique provoquant une PLP. La formation d’un neurinome après une amputation est normale, mais lorsqu’il devient sensibilisé à des stimuli mécaniques ou chimiques, souvent exacerbés par le piégeage, alors les problèmes s’ensuivent. La douleur est intermittente et variable, mais le diagnostic est confirmé par un site spécifique de sensibilité à la palpation, qui peut être confirmé par une injection d’anesthésique local dans le site. Une orientation chirurgicale peut être envisagée, mais le massage, les vibrations, l’acupuncture et la stimulation électrique transcutanée des nerfs (TENS) peuvent également désensibiliser efficacement la zone. C’est aussi un travail excluant la tension musculaire/spasme comme cause en évaluant les points locaux et les points gâchettes dans les tissus mous.
La combinaison de la thérapie physique et de l’ergothérapie avec une compréhension cognitive de la condition amplifiera les effets du traitement. Nous devrions viser à équiper et à responsabiliser le patient, en l’informant de son état et de la façon dont il peut prendre le contrôle tout en cherchant à modifier les croyances et les actions destructives ou erronées. Les stratégies d’auto-traitement courantes peuvent inclure le port d’une chaussette élastique pour moignon afin de minimiser les changements de volume du membre résiduel, le massage du moignon, l’imagerie mentale du membre fantôme et la pratique d’exercices physiques.
La visualisation des mouvements du membre et l’utilisation de la prothèse peuvent réduire la PLP, c’est particulièrement le cas pour les amputés des membres supérieurs. Les dysfonctions articulaires proximales au membre résiduel et l’adaptation prothétique vont cependant compromettre cet effet. Une bonne utilisation de la prothèse est vitale. La normalisation du schéma de marche est, en partie, due à l’ajustement et à l’alignement de la prothèse. Elle dépend également d’une bonne proprioception, d’un schéma moteur correct et d’un contrôle symétrique du mouvement permettant la dissociation du mouvement entre le tronc et le membre. À leur tour, le(s) membre(s) résiduel(s), le tronc et les segments spinaux doivent avoir une amplitude et un contrôle des mouvements suffisants pour obtenir un schéma de marche symétrique. Lorsque le port du membre n’est pas possible, le thérapeute doit faire appel à sa créativité pour rechercher des moyens de simuler des stimuli visuels et même moteurs afin de mimer l’utilisation du membre.
La thérapie par le miroir
La thérapie par le miroir est une intervention thérapeutique, dont il a été démontré qu’elle affecte les processus moteurs et sensoriels par la dominance relative de l’entrée visuelle qu’elle fournit. L’effet est créé en regardant un reflet du membre intact, à travers un miroir placé à l’endroit où le membre amputé aurait existé. La plupart des preuves de cette intervention proviennent d’études de cas et de données anecdotiques, avec seulement quelques études bien contrôlées. Moseley a fait valoir que si les mouvements en miroir peuvent exposer le cortex à une entrée sensorielle et motrice, l’effet thérapeutique est amplifié si les réseaux corticaux sont progressivement activés en utilisant la reconnaissance du membre, l’imagerie motrice et enfin, le mouvement en miroir. Cette séquence d’exposition corticale est connue sous le nom d’imagerie motrice graduée. Les cliniciens qui souhaitent ajouter ce programme à leur répertoire de traitement peuvent trouver des ressources sur NOIGroup
|
|
|
Une note sur les médicaments
Le système militaire britannique de gestion de la douleur encourage l’utilisation de médicaments antineurppathiques tels que la prégabaline et l’amitriptyline le plus tôt possible. Le traitement de première intention consiste à essayer jusqu’à 300 mg deux fois par jour de prégabaline et jusqu’à 150 mg d’amitriptyline le soir. Si la prégabaline est insuffisante, ou si la dépression est un problème, la duloxétine peut être utilisée. Les opioïdes sont d’une aide variable. Il se peut que le tapentadol s’avère bénéfique, mais il est trop tôt pour le dire clairement. Si les agents pharmacologiques peuvent être utiles, la manière dont ils sont utilisés est encore plus importante. Les agents pharmacologiques ne vont pas supprimer toute la douleur. Ce qui compte vraiment, c’est que ces agents permettent au patient de « faire plus ». En ce sens, ils peuvent être comparés à l’ancienne publicité pour les confiseries qui suggérait qu’elles vous permettaient de « travailler, vous reposer et jouer » ; l’idée étant que si les agents pharmacologiques n’ont pas cette action, il est inutile de les prendre. Un bon point de départ consiste souvent à permettre un bon sommeil. On peut toujours avoir une bonne nuit après une mauvaise journée, mais jamais une bonne journée après une mauvaise nuit.
Ressources
- Khan TW, Braun EE. Phantom Limb Pain. Encyclopédie des soins de traumatologie. 2015:1235-40.
- Odell R.H., Sorgnard R, Mile R.D., Cary R.M. Nouveau dispositif de traitement pour la douleur du membre fantôme
Ce rapport de cas décrit l’utilisation d’un dispositif de traitement prometteur et relativement nouveau de signalisation cellulaire électrique pour la douleur du membre fantôme.
Practical Pain Managment Vol 15 #4. - Clinique Mayo. La douleur du membre fantôme.
- Coalition des amputés. Phantom limb pain.
- Finn SB, Perry BN, Clasing JE, Walters LS, Jarzombek SL, Curran S, Rouhanian M, Keszler MS, Hussey-Andersen LK, Weeks SR, Pasquina PF. A randomized, controlled trial of mirror therapy for upper extremity phantom limb pain in male amputees. Frontières en neurologie. 2017 Jul 7;8:267.
- Preißler S, Thielemann D, Dietrich C, Hofmann GO, Miltner WH, Weiss T. Preliminary evidence for training-induced changes of morphology and phantom limb pain. Frontières en neurosciences humaines. 2017 Jun 20;11:319.
- Rothgangel A, Braun S, Witte L, Beurskens A, Smeets R. Développement d’un cadre clinique pour la thérapie par le miroir chez les patients souffrant de douleur du membre fantôme : une approche de la pratique fondée sur des preuves. Pain Practice. 2016 Apr 1;16(4):422-34.
- Pinto CB, Velez FG, Bolognini N, Crandell D, Merabet LB, Fregni F. Optimisation de la réadaptation pour la douleur du membre fantôme à l’aide de la thérapie du miroir et de la stimulation transcrânienne à courant direct : A Randomized, Double-Blind Clinical Trial Study Protocol. Protocoles de recherche JMIR. 2016 Jul;5(3).
- Kikkert S, Mezue M, Slater DH, Johansen-Berg H, Tracey I, Makin TR. Corrélats moteurs de la douleur du membre fantôme, cortex. 2017 Oct 1;95:29-36.
- Alison Burger The Phantom Limb Accessed from https://www.youtube.com/watch?time_continue=2&v=5BlsoyE1CIw
- Siddle L. The challenge and management of phantom limb pain after amputation. British Journal of Nursing. 2012;13(11):664-667
- . La douleur après une amputation. BJA Education. 2016;16(3) : 107-112. https://doi.org/10.1093/bjaed/mkv028
- Weinstein, 8e Congrès mondial sur la douleur, 1996 pg.376
- Jensen TS, Krebs B, Nielsen J, Rasmussen P. Immediate and long-term phantom limb pain in amputees : incidence, clinical characteristics and relationship to pre-amputation limb pain. Pain. 1985;21(3):267-78.
- Sherman RA, Sherman CJ. Prévalence et caractéristiques de la douleur chronique du membre fantôme chez les vétérans américains : Results of a Trial Survey. American Journal of Physical Medicine ; Rehabilitation. 1983;62(5):227-38.
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans : results of a survey. Pain. 1984;8(1):83-95.
- 8.0 8.1 8.2 Le Feuvre P, Aldington D. Know Pain Know Gain : proposing a treatment approach for phantom limb pain. J R Army Med Corps. 2014 ; 160(1):16-21 http://jramc.bmj.com/content/160/1/16.full.pdf+html
- 9.0 9.1 Flor H. Phantom-limb pain : characteristics, causes and treatment. Lancet 2002;1:182-9.
- Flor H. Réorganisation corticale et douleur chronique ; implications pour la réhabilitation. J Rehabil Med 2003;41:66-72.
- Noir LM, Persons RK, Jamieson MLS. Quelle est la meilleure façon de gérer la douleur du membre fantôme ? J fam practice 2009;58:155-8.
- Bradbrook D. Traitement par acupuncture de la douleur du membre fantôme et de la sensation de membre fantôme chez les amputés. Acupunct Med 2004;22:93-7.
- Butler D, Moseley GL. Expliquer la douleur. Noigroup Publications, 2010
- 14,0 14,1 Moseley GL. Imagerie motrice graduée pour la douleur pathologique : un essai contrôlé randomisé. Neurologie 2006;67:2129-34.
- MacIver K, Lloyd DM, Kelly S, et al. Phantom limb pain, cortical reorganization and the therapeutic effect of mental imagery. Brain 2008;131:2181-91.
- 16.0 16.1 Moseley GL, Gallace A, Spence C. Is mirror therapy all it is cracked to be ? Current evidence and future directions. Pain. 2008;138:1387-10.
- Institut neuro-orthopédique NOI Mirror Box Therapy avec David Butler Accessed fromhttps://www.youtube.com/watch?time_continue=1&v=hMBA15Hu35M
- Institut neuro-orthopédique NOI What is Graded Motor Imagery Accessed from https://www.youtube.com/watch?time_continue=1&v=fWYUJscRBRw