Alors, comment les océans se sont-ils formés en premier lieu ? Rappelez-vous de la section 3.1 que la Terre primitive s’est formée par accrétion de divers matériaux, et qu’une période de fonte et d’intense activité volcanique a suivi. Les matériaux qui se sont accrétés sur la Terre primitive contenaient les composants qui allaient devenir nos océans et notre atmosphère. Sous les pressions élevées que l’on trouve à l’intérieur de la Terre, les gaz restent dissous dans le magma. Lorsque ces magmas remontent à la surface par l’activité volcanique, la pression diminue et les gaz sont libérés par un processus appelé dégazage. L’activité volcanique libère de nombreux gaz différents, dont la vapeur d’eau, le dioxyde de carbone (CO2), le dioxyde de soufre (SO2), le monoxyde de carbone (CO), le sulfure d’hydrogène (H2S), l’hydrogène gazeux, l’azote et le méthane (CH4). Les gaz plus légers comme l’hydrogène et l’hélium se sont dissipés dans l’espace, mais les gaz plus lourds sont restés et ont formé l’atmosphère primitive de la Terre.
Lorsque la Terre primitive s’est refroidie, la vapeur d’eau présente dans l’atmosphère s’est condensée et est tombée sous forme de pluie. Il y a environ 4 milliards d’années, les premières accumulations permanentes d’eau étaient présentes sur Terre, formant les océans et d’autres masses d’eau. L’eau se déplace entre ces différents réservoirs par le biais du cycle hydrologique. Sous l’effet de l’énergie solaire, l’eau s’évapore des océans, des lacs, des cours d’eau, de la surface des terres et des plantes (transpiration) (figure 5.2.1). Elle est déplacée dans l’atmosphère par les vents et se condense pour former des nuages de gouttelettes d’eau ou de cristaux de glace. Elle redescend sous forme de pluie ou de neige, puis s’écoule dans les ruisseaux et les rivières, dans les lacs et finalement dans les océans. L’eau à la surface et dans les cours d’eau et les lacs s’infiltre dans le sol pour devenir une eau souterraine. Les eaux souterraines se déplacent lentement à travers la roche et les matériaux de surface ; une partie retourne dans d’autres cours d’eau et lacs, et une autre retourne directement dans les océans.
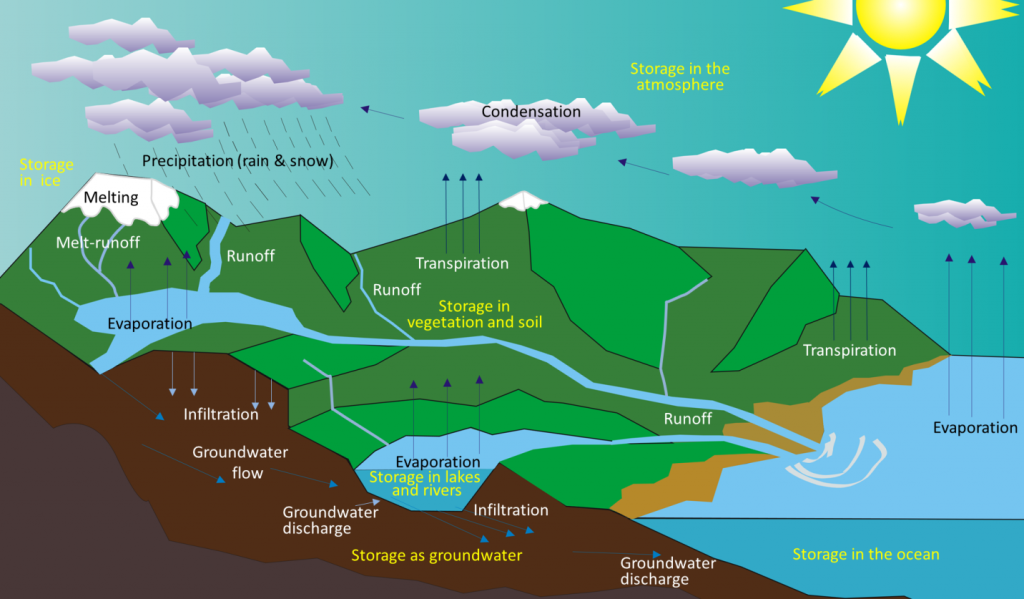
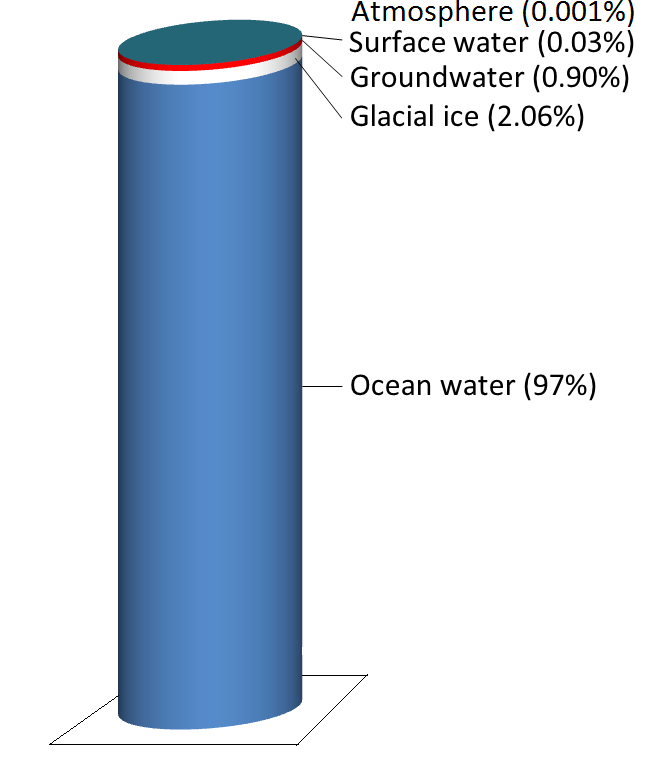
L’eau est stockée dans divers réservoirs au fur et à mesure qu’elle avance dans ce cycle. Le plus important, et de loin, est constitué par les océans, qui représentent 97 % du volume (figure 5.2.2). Bien entendu, cette eau est salée. Les 3 % restants sont de l’eau douce. Les deux tiers de notre eau douce sont stockés dans le sol et un tiers dans la glace. L’eau douce restante – environ 0,03 % du total – est stockée dans les lacs, les cours d’eau, la végétation et l’atmosphère.
Pour mettre cela en perspective, pensons à mettre toute l’eau de la Terre dans une cruche d’un litre. Nous commençons par remplir presque entièrement la cruche avec 970 ml d’eau et 34 g de sel. Puis nous ajoutons un glaçon de taille normale (~20 ml) (représentant la glace glaciaire) et deux cuillères à café (~10 ml) d’eau souterraine. Toute l’eau que nous voyons autour de nous dans les lacs et les cours d’eau et là-haut dans le ciel peut être représentée en ajoutant trois autres gouttes provenant d’un compte-gouttes.
Bien que la proportion d’eau de la Terre qui se trouve dans l’atmosphère soit minuscule, le volume réel est énorme. À tout moment, il y a l’équivalent d’environ 13 000 km3 d’eau dans l’air sous forme de vapeur d’eau et de gouttelettes d’eau dans les nuages. L’eau s’évapore des océans, de la végétation et des lacs au rythme de 1 580 km3 par jour, et un volume à peu près équivalent tombe sous forme de pluie et de neige chaque jour, tant sur les océans que sur les terres. Les précipitations qui tombent sur les terres retournent à l’océan sous forme de débit de cours d’eau (117 km3/jour) et d’écoulement souterrain (6 km3/jour).
Comment les océans sont-ils devenus salés ?
Le dégazage a été responsable de la formation des océans, mais comment l’eau des océans est-elle devenue salée ? La plupart des sels et des éléments dissous dans l’océan ont probablement été dégazés en même temps que la vapeur d’eau, si bien que l’océan a probablement toujours été à peu près aussi salé qu’aujourd’hui. Mais nous savons que les précipitations et d’autres processus altèrent les roches à la surface de la Terre, et que le ruissellement entraîne des substances dissoutes dans l’océan, contribuant ainsi à sa salinité. Pourtant, malgré cet apport constant, la composition en sel de l’océan reste essentiellement la même. Par conséquent, le taux d’apport de nouvelles matières doit être équilibré par le taux d’élimination ; en d’autres termes, les océans sont dans un état stable en ce qui concerne la salinité.
Il existe de multiples voies par lesquelles les ions dissous pénètrent dans l’océan ; le ruissellement des cours d’eau et des rivières, l’activité volcanique, les évents hydrothermaux (voir section 4.11), la dissolution ou la désintégration des substances dans l’océan et l’apport des eaux souterraines. Les ions sont retirés de l’eau de mer lorsqu’ils sont incorporés par les organismes vivants (par exemple dans la production de coquillages) ou les sédiments, les embruns marins, la percolation de l’eau dans la croûte, ou lorsque l’eau de mer est isolée de l’océan et s’évapore.
La relation entre l’apport et le retrait d’un ion peut être examinée à travers le concept de temps de résidence, qui est la durée moyenne pendant laquelle un seul atome d’un élément reste dans l’océan avant d’être retiré. Le temps de résidence est calculé comme suit :
![]()
Il existe une grande variation des temps de résidence pour différentes substances (tableau 5.2.1). En général, les substances qui sont facilement utilisées dans les processus biologiques ont des temps de séjour courts, car elles sont utilisées dès qu’elles sont disponibles. Les substances dont le temps de résidence est plus long sont moins réactives et peuvent faire partie de cycles géologiques à longue échelle.
Tableau 5.2.1 Temps de résidence de quelques constituants de l’eau de mer
| Constituant | Temps de résidence (années) |
|---|---|
| Chlorure (Cl-…) | 100,000,000 | Sodium (Na+) | 68, 000, | Calcium (Ca2+) | 1, 000,000 |
| Eau | 4100 |
| Fer (Fe) | 200 |
Et les lacs ? Ils sont soumis au ruissellement et à l’apport des rivières, alors pourquoi ne sont-ils pas salés comme les océans ? L’une des raisons est que, par rapport aux océans, les lacs et les étangs sont des phénomènes relativement temporaires, ils ne durent donc pas assez longtemps pour accumuler les mêmes niveaux d’ions que les océans. En outre, les lacs sont souvent traversés par des rivières qui s’y jettent et en sortent, de sorte que de nombreux ions sont éliminés par le débit sortant et finissent par se retrouver dans les océans. Les océans ne reçoivent que l’apport des rivières ; il n’y a pas de rivières qui sortent de l’océan pour éliminer ces matériaux, qui se trouvent donc en plus grande abondance dans l’eau de mer. Il convient de noter que certains lacs contiennent de l’eau dont la teneur en sel peut rivaliser avec celle de l’océan, voire la dépasser ; ces lacs n’ont généralement pas d’écoulement fluvial. Le Grand Lac Salé, dans l’ouest des États-Unis, en est un exemple.
* »Physical Geology » par Steven Earle utilisé sous une licence internationale CC-BY 4.0. Téléchargez ce livre gratuitement sur http://open.bccampus.ca
le processus par lequel des corps célestes solides sont ajoutés à des corps existants lors de collisions (3.1)
Roche fondue généralement dominée par la silice (3.2)
où les substances dissoutes dans les magmas sont libérées sous forme de gaz lorsque la pression est réduite (5.2)
la production de composés organiques à partir de dioxyde de carbone et d’eau, en utilisant la lumière du soleil comme source d’énergie (5,5)
(Megaannus) des millions d’années avant le présent
le cycle de l’eau à travers l’océan, l’atmosphère, les lacs, les organismes et autres réservoirs (5.2)
l’eau qui se trouve sous la surface du sol (5.2)
l’écoulement de l’eau le long d’une pente, soit à la surface du sol, soit à l’intérieur d’une série de canaux (12.2)
où un système ne présente aucun changement net, l’entrée étant égale à la sortie (5.2)
Superficie du plancher océanique où l’eau surchauffée s’infiltre hors de la croûte (4.11)
particules non consolidées de minéraux ou de roches qui se déposent sur le plancher océanique (12.1)
la durée moyenne pendant laquelle un élément restera dans l’océan avant d’être éliminé (5,2)
.