
Lorsque les cliniciens mesurent le cortisol salivaire et la DHEA (DHEA-S) pour évaluer le stress et la fonction de l’axe HPA, il est courant de trouver des niveaux de DHEA inférieurs à la plage de référence chez un certain nombre d’individus. Une explication courante de la déplétion de la DHEA et d’autres hormones (par exemple, la progestérone, la testostérone) due au stress chronique est le phénomène connu sous le nom de « vol de pregnénolone. »
La notion de vol de prégnénolone stipule que puisque toutes les hormones stéroïdiennes utilisent la prégnénolone (dérivée du cholestérol) comme précurseur, la sécrétion élevée de cortisol causée par un stress aigu ou chronique entraînera inévitablement une diminution de la quantité de prégnénolone disponible pour servir de précurseur à la production de DHEA et d’autres hormones en aval.
En d’autres termes, selon cette théorie, le besoin de synthèse du cortisol « vole » la prégnénolone à d’autres voies hormonales, réduisant la synthèse et la sécrétion potentielles d’autres hormones nécessaires, ce qui entraîne certains des changements physiopathologiques liés au stress. Bien qu’une augmentation des niveaux de cortisol et une baisse concomitante de la DHEA soient l’une des caractéristiques cliniques de la progression du stress chronique aux stades précoce et intermédiaire, ce phénomène n’est pas dû à une diminution de la disponibilité de la prégnénolone surrénalienne ou à un « vol de prégnénolone ». La raison la plus évidente est le fait que la conversion du cholestérol en prégnénolone se produit dans les mitochondries de chaque type de cellule corticosurrénalienne respective qui est responsable de la production de ces hormones.
Pour dire les choses simplement, il n’existe pas de pool surrénalien connu de prégnénolone qu’une cellule pourrait voler à une autre, et aucun mécanisme connu n’a été décrit qui pourrait faciliter le transfert de prégnénolone entre les mitochondries de différentes cellules (dans ce cas, des mitochondries des cellules de la zone réticulaire à celles de la zone fasciculée). Malheureusement, les figures les plus couramment utilisées pour enseigner la stéroïdogenèse montrent une voie commune et ne précisent généralement pas la régulation différentielle des enzymes disponibles entre les différents tissus stéroïdogènes. Cela conduit de nombreuses personnes à supposer, à tort, qu’il existe un seul « réservoir » de prégnénolone disponible pour la synthèse de toutes les hormones stéroïdiennes dans la surrénale. Une bien meilleure façon d’enseigner cela est de montrer les différentes enzymes disponibles pour chaque cellule du cortex surrénalien, en montrant que chacune est capable de convertir le cholestérol en prégnénolone, puis en diverses hormones nécessaires. La figure suivante est extraite de The Standard Road Map, The Role of Stress and the HPA Axis in Chronic Disease Management. Elle démontre une meilleure façon d’enseigner ce concept, qui évite de montrer un seul » pool » de prégnénolone pour toutes les hormones en aval.
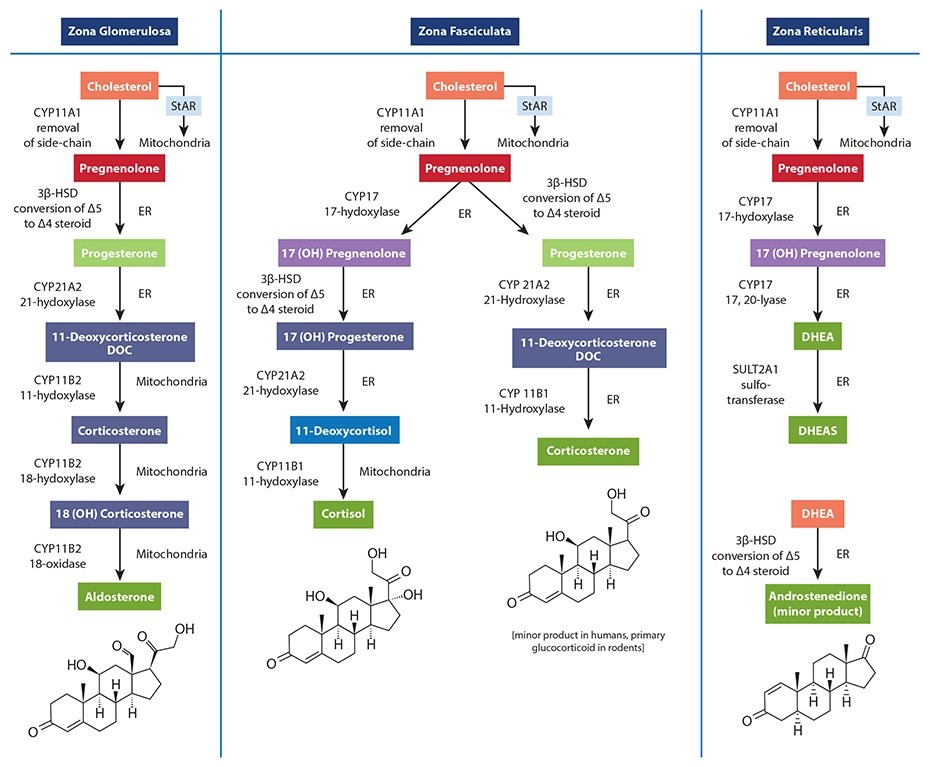
En outre, la synthèse surrénalienne du cortisol induite par l’ACTH est de plusieurs ordres de grandeur supérieure à celle de la DHEA, et fluctue radicalement au cours d’une période de 24 heures. S’il existait un « pool de prégnénolone » surrénalien contenant suffisamment de précurseurs de la prégnénolone pour une production élevée de cortisol le matin (ou pendant le stress), ce « pool » serait alors également disponible pour la quantité beaucoup plus faible de production de DHEA nécessaire lorsque la synthèse de cortisol diminue même un peu.
La recherche a montré que le contrôle de la production d’hormones surrénaliennes est régulé principalement par des concentrations d’enzymes spécifiques aux cellules et des signaux externes provenant de l’extérieur de la glande surrénale.
Enfin, comme l’ont montré des décennies de recherche sur la stéroïdogenèse, le contrôle de la production d’hormones surrénaliennes est régulé principalement par des concentrations d’enzymes spécifiques aux cellules et des signaux externes provenant de l’extérieur de la glande surrénale (Voir notre dernier livre pour plus de détails). Qu’est-ce que cela signifie alors par rapport à la production de cortisol et de DHEA qui, lorsqu’elle est mesurée, semble confirmer ce phénomène ? Qu’en est-il du rôle de la thérapie orale de pregnenolone pour soutenir la production de DHEA surrénalienne ? Eh bien, c’est un peu compliqué. Tandis que le stress de l’axe HPA et la synthèse et la sécrétion subséquentes de cortisol peuvent être liés à l’accélération de la production réduite de DHEA (c.-à-d., une dérégulation de DHEA induite par le stress), cette relation est facilitée par des processus de régulation (par exemple, des inhibitions de rétroaction, la signalisation de récepteur, la régulation génomique des enzymes, etc. Par exemple, il a été démontré que l’hyperglycémie et l’hyperinsulinémie induites expérimentalement affectent la production de DHEA et d’androstènedione chez les sujets humains.
Dans une étude portant sur des sujets diabétiques de type 2 mal contrôlés, présentant un taux élevé de cortisol et un faible taux de DHEA, il a été démontré que l’enzyme nécessaire à la formation de DHEA dans la zone réticulaire (17,20 lyase) limitait la production de DHEA. L’activité enzymatique a été corrigée (en même temps que la normalisation des taux de cortisol, de DHEA et de DHEA-S) après six mois de régime ou de pharmacothérapie pour améliorer le contrôle de la glycémie. En outre, des études sur des cultures cellulaires suggèrent que, en cas de stress inflammatoire (IL-4 et autres cytokines), la zone réticulaire régule à la baisse la production de DHEA en présence d’ACTH. Ces facteurs, ainsi que de nombreux autres (par exemple, le vieillissement), sont probablement les influences motrices qui affectent la relation dynamique entre le cortisol (activé par l’axe HPA) et les niveaux mesurés de DHEA et/ou de DHEA-S. En réévaluant les mécanismes spécifiques qui conduisent les changements liés au stress dans la production d’hormones surrénaliennes, et en s’éloignant des explications anciennes et incorrectes, nous sommes en mesure de rechercher (et peut-être de traiter) les différents signaux qui sont réellement responsables de la modulation de la sécrétion d’hormones surrénaliennes au cours de la progression du stress chronique.
Si vous souhaitez en savoir plus sur ce sujet et sur la façon dont la prégnénolone et la DHEA par voie orale peuvent améliorer les résultats chez les sujets présentant des dysfonctionnements liés au stress, veuillez envisager d’acheter The Role of Stress and the HPA Axis in Chronic Disease Management.
Ressources connexes
- Blog : Est-ce de la fatigue surrénalienne ? Réévaluation de la nomenclature des dysfonctionnements de l’axe HPA.
- Blog : Comment utiliser la réponse d’éveil du cortisol (CAR) pour aborder la fonction surrénalienne
- Blog : Fluctuations diurnes de la norépinéphrine & Epinéphrine dans le cadre de la réponse au stress de la santé
Boudou P, Sobngwi E, Ibrahim F et al. L’hyperglycémie diminue de façon aiguë les niveaux de déhydroépiandrostérone circulante chez les hommes sains. Clin Endocrinol (Oxf). 2006 Jan;64(1):46-52.
Vásárhelyi B, Bencsik P, Treszl A, et al. The effect of physiologic hyperinsulinemia during an oral glucose tolerance test on the levels of dehydroepiandrosterone (DHEA) and its sulfate (DHEAS) in healthy young adults born with low and with normal birth weight. Endocr J. 2003 Dec;50(6):689-95.
Ueshiba H, Shimizu Y, Hiroi N et al. Diminution de l’enzyme stéroïdogène 17,20-lyase et augmentation des activités de la 17-hydroxylase dans le diabète sucré de type 2. Eur J Endocrinol. 2002 Mar;146(3):375-80.
Woods AM, Judd AM. L’interleukine-4 augmente la libération de cortisol et diminue la libération d’androgènes surrénaliens à partir de cellules surrénaliennes bovines. Domest Anim Endocrinol. 2008 May;34(4):372-82.
Woods AM, McIlmoil CJ, Rankin EN. Et al. La protéine et les récepteurs du facteur inhibiteur de la leucémie sont exprimés dans le cortex surrénalien bovin et augmentent le cortisol et diminuent la libération d’androgènes surrénaliens. Domest Anim Endocrinol. 2008 Aug;35(2):217-30.