La simulation informatique s’attaque au problème de la coagulation du sang
Créer un rein artificiel implantable serait une avancée épique de la médecine et pourrait répondre à la pénurie chronique de reins de donneurs nécessaires à la transplantation. Les chercheurs poursuivent cette quête depuis 15 ans et se heurtent sans cesse à un problème extrêmement noueux : comment faire en sorte que le sang circule sans problème dans le dispositif artificiel sans coaguler. Dans de tels dispositifs, comme les plaquettes sanguines réagissent aux forces mécaniques, elles ont une tendance naturelle à coaguler, ce qui entraîne un dysfonctionnement du dispositif.
Pour surmonter ce problème, les lauréats des Quantum Awards de l’Institut national d’imagerie biomédicale et de bioingénierie (NIBIB) ont combiné une expertise rare dans le développement de reins artificiels et dans la simulation informatique du flux sanguin, dans une étude parue dans le numéro en ligne avancé du Journal of Biomechanics du 16 janvier 2018.
Bien que la dialyse sauve des milliers, voire des millions, de vies chaque année, elle ne constitue pas une solution idéale pour les maladies rénales. Au lieu d’une filtration continue du sang, qui maintient la chimie du sang dans une fourchette saine, la dialyse entraîne un sang ultra-nettoyé et appauvri en nutriments, qui devient progressivement plus toxique jusqu’au traitement de dialyse suivant.
Ce que font les reins-
Les reins extraient les toxines du sang et maintiennent l’équilibre des fluides dans le corps par l’excrétion d’urine. Ils fabriquent également des hormones pour réguler la pression artérielle, favoriser la production de globules rouges et soutenir la santé osseuse.
Lorsque les reins sont défaillants-
Les maladies rénales peuvent entraîner une défaillance des reins et une accumulation de toxines dans le sang. L’insuffisance rénale touche plus de 660 000 personnes par an aux États-Unis et contribue à 89 000 décès.
Certaines personnes souffrant d’insuffisance rénale ont la chance de recevoir le rein d’un donneur transplanté. Sur les 100 000 personnes inscrites chaque année sur la liste d’attente des greffes, seules 18 000 reçoivent un rein de donneur. Une mesure palliative pour les patients dans ces conditions de danger de mort est la dialyse, un moyen de traiter le sang à travers un système de filtration externe.
Un rein artificiel offrirait le bénéfice d’une filtration sanguine continue. Il permettrait de réduire les maladies rénales et d’augmenter la qualité de vie des patients. Alors que les chercheurs ont fait des progrès sur les modèles portables, pour rendre le dispositif implantable – entraîné par les flux sanguins du corps – le problème des caillots devrait être résolu.
« Comme les développeurs de cette technologie ne le savent que trop bien, il est particulièrement frustrant de faire face aux caillots sanguins, qui peuvent à la fois boucher le dispositif, le rendant inutile, et causer des dangers pour d’autres parties du corps où la circulation sanguine serait compromise », a déclaré Rosemarie Hunziker, directrice du programme NIBIB en ingénierie tissulaire et médecine régénérative. « Un caillot qui migre vers le cœur pourrait provoquer une crise cardiaque ; il pourrait provoquer un accident vasculaire cérébral s’il se déplace vers le cerveau. »
Le rein artificiel implantable – un dispositif de bio-ingénierie qui combine un filtre en silicium à haute efficacité et un bioréacteur de cellules tubulaires rénales – a été un projet à long terme pour les coauteurs de l’étude, Shuvo Roy, Ph.D., professeur de bio-ingénierie et de sciences thérapeutiques à l’Université de Californie, San Francisco (UCSF), et William H. Fissell, IV, M.D., professeur associé de médecine à l’Université de Vanderbilt.
Le dispositif expérimental est conçu pour accueillir jusqu’à un litre de sang par minute, en le filtrant à travers un réseau de membranes en silicone. Le fluide filtré contient des toxines, de l’eau, des électrolytes et des sucres. Le fluide subit ensuite une deuxième étape de traitement dans un bioréacteur de cellules cultivées en laboratoire, du type de celles qui tapissent normalement les tubules des reins. Ces cellules réabsorbent la plupart des sucres, des sels et de l’eau dans la circulation sanguine. Le reste devient de l’urine qui est dirigée vers la vessie et hors du corps.
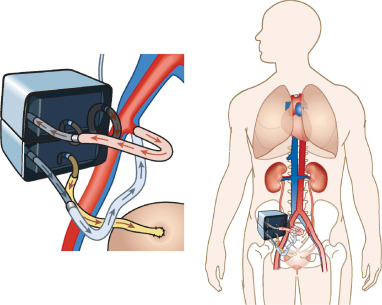
Une grande partie de la technologie permettant de mettre en œuvre ce processus complexe existe, une partie ayant été développée par Roy et Fissell dans le cadre d’un financement antérieur du programme NIBIB Quantum Award. L’un des défis restants est que les chercheurs intègrent les diverses innovations dans un dispositif fonctionnel, compact – et donc implantable.
Dans les travaux nouvellement publiés, l’équipe UCSF-Vanderbilt a collaboré avec le coauteur Danny Bluestein, docteur en médecine, professeur d’ingénierie biomédicale à l’Université d’État de New York, Stony Brook, qui est également un bénéficiaire du Quantum Award. En 2010, le NIBIB a accordé au laboratoire de Bluestein une subvention pour étudier la thromborésistance, c’est-à-dire la prévention de la coagulation dans le sang en circulation. Le groupe de Bluestein a utilisé cette technique pour étudier les dispositifs d’implants cardiovasculaires, tels que les valves cardiaques artificielles, ainsi que le dispositif utilisé en chirurgie lors d’une dérivation temporaire de la circulation cardiaque.
Roy et Fissell ont entendu parler pour la première fois de la méthodologie de Bluestein, appelée émulation de la thrombogénicité du dispositif (DTE), lors d’une réunion en 2014 au NIBIB pour les bénéficiaires de Quantum Award. La méthodologie DTE de Bluestein quantifie les schémas d’écoulement et les facteurs de stress qui se développent pendant l’écoulement du sang. Pendant la description de la DTE par Bluestein, Roy et Fissell ont immédiatement vu le potentiel d’application de ses théories à la conception de leur rein artificiel. Une simulation informatique appropriée pourrait faire gagner des années, voire des décennies, sur le processus de conception du rein artificiel et produire un dispositif avec un profil de sécurité bien analysé et testé pour l’activation des plaquettes et la formation subséquente de caillots.
« Les plaquettes s’activent, et initient la coagulation du sang en réponse à la gravité des forces de stress, ainsi qu’à la durée de circulation des plaquettes dans le dispositif », a déclaré Bluestein. La méthodologie de simulation de Bluestein – d’abord développée pour prédire numériquement l’accumulation de stress sur les plaquettes dans les dispositifs qui soutiennent la circulation chez les patients souffrant d’insuffisance cardiaque – était facilement adaptable aux aspects de dynamique des fluides du rein artificiel.
Les chercheurs ont généré des résultats de simulation et d’optimisation pour deux conceptions de dispositifs qui canalisent chacun le sang à travers le système de filtre du rein artificiel. Grâce à la simulation, ils ont calculé qu’une plaquette individuelle peut circuler dans le rein artificiel jusqu’à 1 000 fois, accumulant le stress et augmentant la tendance à la coagulation à chaque passage. L’un des modèles distribue le sang dans des canaux parallèles qui traversent plusieurs couches de membranes filtrantes. L’autre canalise le sang d’avant en arrière à travers un seul chemin en serpentin.
Les résultats de la simulation ont penché en faveur du système à flux parallèle, notamment en ce qui concerne l’état des plaquettes sanguines après une circulation répétée dans les systèmes de filtration. Toutefois, les deux conceptions ont satisfait aux critères prédéterminés par les chercheurs en ce qui concerne l’écoulement uniforme du sang dans les dispositifs et l’accumulation des forces de contrainte de cisaillement sur les plaquettes contre les parois des canaux d’écoulement des dispositifs. Par conséquent, les chercheurs prévoient de tester les deux modèles d’implants dans des expériences prospectives sur des porcs. D’autres conceptions pourraient être testées à l’avenir.
« Je suis heureux qu’ils aient décidé d’adopter notre méthodologie, afin que son efficacité puisse être démontrée dans un type de dispositif très différent », a déclaré Bluestein. « La coagulation du sang est le principal problème clinique qui peut survenir en raison des contraintes induites par l’écoulement qui existent dans tous ces dispositifs. »
L’approche de simulation a accéléré le projet en économisant sur l’expérimentation animale et en offrant une alternative viable pour examiner les avantages et les inconvénients des différents dispositifs qui entrent en contact avec le sang. « Faire cela dans le cadre d’études sur les animaux prend du temps, coûte cher et, à un certain niveau, vous ne savez jamais si cela va fonctionner – parce que le sang animal n’est pas le même que le sang humain », a déclaré Roy. « Nous avons fini par tirer parti de la vaste suite de travaux réalisés par le Dr Bluestein et ses collègues et avons appliqué des méthodologies en dynamique des fluides computationnelle pour nous aider à analyser nos conceptions. »
Le dispositif aura-t-il toutes les fonctions d’un rein natif ? « Non », a déclaré M. Roy. « Mais l’objectif est qu’il remplisse les fonctions qui sont critiques et qu’il soit un dispositif qui, une fois implanté, permettra au patient de manger et de boire librement, d’avoir une mobilité, une meilleure santé globale et, contrairement à une transplantation, de ne pas avoir besoin de médicaments immunosuppresseurs. »
Hunziker a applaudi la collaboration entre les lauréats du prix Quantum du NIBIB – un programme visant à mettre les nouvelles technologies au service des grands problèmes insolubles de la médecine. « Voir des équipes financées indépendamment s’assembler pour tirer parti de leurs innovations quantiques est extrêmement gratifiant », a-t-elle déclaré. « Cette collaboration permet d’accélérer le développement du rein artificiel via une modélisation prédictive efficace, associée à une capacité approfondie de manipulation des biomatériaux et à une connaissance approfondie de la physiopathologie rénale. »
L’étude a été soutenue en partie par le NIBIB (EB014315, EB012487 et EB021214).
L’analyse de l’accumulation du stress des plaquettes pour prédire la thrombogénicité d’un rein artificiel. Buck AKW, Goebel SG, Goodin MS, Wright NJ, Groszek JJ, Moyer J, Singh S, Bluestein D, Fissell WH, Roy S. J Biomech. 2018 Jan 16.