Parce que la sécheresse oculaire (DED), comme ses pathologies associées, implique le plus souvent un processus inflammatoire, la logique peut dicter qu’un traitement réussi ne nécessite rien d’autre que d’éliminer l’inflammation. Cependant, le traitement est rarement aussi simple. Les cliniciens ne se préoccupent plus uniquement de traiter l’inflammation – aujourd’hui, nous visons à traiter sa cause sous-jacente.
L’œil sec et ses composantes ne sont pas toujours faciles à diagnostiquer. Comme nous l’avons appris dans le rapport DEWS, la DED est une maladie multiforme des larmes et de la surface oculaire qui se traduit par des symptômes tels que la sécheresse, des démangeaisons, des picotements, des brûlures, une vision floue, une sensation granuleuse ou sableuse, un larmoiement excessif, une photophobie et, enfin et surtout, des troubles visuels1-3.
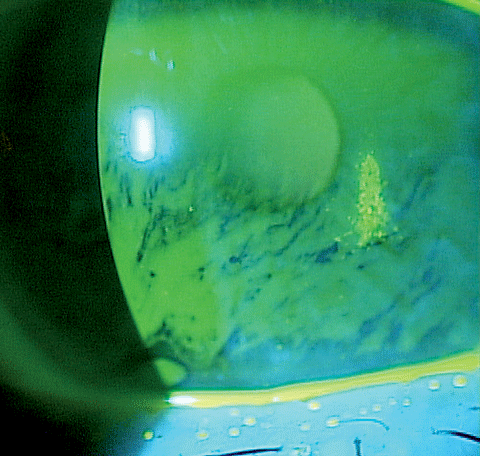
La coloration cornéenne chez ce patient atteint de sécheresse oculaire montre une perturbation de la barrière épithéliale. Une variété de nouveaux outils pour lutter contre les facteurs associés à la pathogenèse de l’œil sec sont arrivés sur le marché au cours des dernières années. Cliquez sur l’image pour l’agrandir.
Une fois le diagnostic posé, le traitement ultérieur doit inclure une évaluation des facteurs systémiques ou environnementaux, surtout si la présentation ne correspond pas à l’âge ou à l’état de santé général du patient.
Cet article donne un aperçu des dernières méthodes et des derniers dispositifs mis à la disposition des optométristes pour traiter l’œil sec, en particulier ceux qui concernent l’œil sec évaporatif.
La marée montante
L’œil sec découle généralement de l’une des deux étiologies suivantes : carence aqueuse ou dysfonctionnement des glandes meibomiennes (MGD).3 La courbe du diagnostic est que les deux peuvent être présents en même temps3. Il y a quelques années, lorsque l’œil sec était considéré comme une simple nuisance, le traitement de l’œil sec déficient en eau (ADDE) comprenait des larmes artificielles et une occlusion ponctuelle, tandis que le traitement de la MGD se limitait à une doxycycline ou une tétracycline orale à faible dose et à long terme et à des compresses chaudes. Puis, Restasis (cyclosporine, Allergan) est arrivé et a bouleversé les idées reçues. Soudain, la communauté des ophtalmologistes disposait d’un moyen manifestement efficace d’augmenter la production de larmes. Depuis lors, la discipline a montré un intérêt croissant pour s’attaquer à ce qui était souvent rejeté comme une plainte gênante.
Et c’est une nuisance non seulement pour les patients atteints de MGD – qui subissent un impact durable sur leur qualité de vie – mais aussi pour les cliniciens, qui constatent une augmentation spectaculaire de la prévalence de la DED3-6. Une étude Gallup de 2012 sur les personnes souffrant de sécheresse oculaire prévoyait une croissance de 10,2 % au cours des 10 prochaines années.6
Les recherches montrent que la DED est présente chez environ la moitié des patients qui portent des lentilles de contact7. Chez les patients diabétiques, elle atteindrait 54 %.8 Chez les patients atteints de glaucome ou d’hypertension oculaire, elle atteindrait 59 %.9 Une récente étude prospective de patients programmés pour un DED, utilisant l’échelle de l’International Task Force – où deux est considéré comme un niveau modéré de DED – a indiqué que 80,9 % des patients programmés pour une chirurgie de la cataracte ont obtenu un score de deux ou plus.10 Pourtant, seuls 22,1 % de ces patients avaient déjà reçu un diagnostic de DED.10
Quelque chose dans l’air
Un homme blanc de 24 ans s’est présenté le matin en se plaignant d’avoir les yeux rouges et irrités après avoir travaillé sur un ordinateur toute la journée. Cependant, à l’examen, ses yeux semblaient remarquablement sains. Un autre optométriste lui avait auparavant diagnostiqué une fatigue visuelle liée à l’ordinateur et lui avait prescrit des lunettes pour ordinateur, qui n’avaient apporté qu’un certain soulagement.
Le patient a été reprogrammé pour un rendez-vous en fin de journée, au cours duquel il a présenté des yeux très irrités avec un œdème conjonctival 3+ et une OU d’injection 1++. On lui a prescrit Lotemax (étabonate de lotéprednol, Bausch + Lomb) OU QID pendant deux semaines.
Lors du suivi, le patient a signalé une amélioration de ses symptômes ; cependant, il était clair que quelque chose sur son lieu de travail était à l’origine du problème. Il a nié avoir connaissance d’une fenêtre ou d’un évent créant un flux d’air. On lui a demandé d’enquêter sur toute circulation d’air possible dans son environnement de travail et de diminuer progressivement le Lotemax au cours des deux semaines suivantes.
Lors du suivi, il a déclaré avoir arrêté d’utiliser le Lotemax le lendemain de sa dernière visite et n’avoir eu aucun problème depuis. Il avait trouvé un évent qui créait indirectement un flux d’air sur son visage au travail, et avait ajusté l’évent en conséquence, ce qui a résolu le problème.
La leçon : malgré notre arsenal sans cesse croissant de thérapies sophistiquées pour l’œil sec, le fait de prêter parfois une attention particulière aux conditions dans lesquelles nos patients travaillent, vivent et jouent permet d’obtenir des ajustements simples qui peuvent apporter des améliorations durables.
Ajoutez à ces statistiques la prise de conscience que la prévalence de l’œil sec augmente avec l’âge, et que notre population vieillissante continue de croître, et il est raisonnable d’être à l’affût de ce processus pathologique chez tous les patients de plus de 65 ans11.
La conclusion : il est fort probable que vous rencontriez l’œil sec à un rythme croissant, et avec autant de méthodes de traitement disponibles, vous pouvez être responsable de la restauration de la qualité de vie des patients, qu’ils aient développé l’œil sec après une chirurgie, des années d’utilisation de lentilles de contact ou simplement en raison de l’âge.
Anatomie du film lacrymal
Pour traiter correctement la MGD, les cliniciens doivent d’abord bien maîtriser l’anatomie du film lacrymal et les origines de chaque couche – des éléments critiques qui vous aident à déterminer le traitement le plus approprié pour résoudre le processus pathologique sous-jacent qui a entraîné la DED.
Pour faire un bref rappel, le film lacrymal est composé de trois couches : mucine, aqueuse et lipidique.12
La couche de mucine, d’une épaisseur d’environ 0,02µm à 0,05µm, est la couche la plus interne et la plus fine. Elle maintient la stabilité du film lacrymal et est un produit des cellules gobelets conjonctivales.12 Les cellules épithéliales produisent du glycocalyx pour aider à lier la couche de mucine à la surface épithéliale.12
La couche aqueuse, d’environ 0,7µm d’épaisseur, est la plus épaisse des trois. Cette couche intermédiaire est formée par les sécrétions des glandes lacrymales et accessoires. Elle contient des électrolytes, des protéines, des anticorps, de l’oxygène, du dioxyde de carbone, des minéraux et du glucose.12
La couche externe, constituée de lipides, a une épaisseur d’environ 0,1µm et contient des esters et du glycérol ainsi que des acides gras. Sa fonction est d’empêcher l’évaporation des aqueux. Cette couche est un produit des glandes de Meibomius et des glandes de Zeiss.12
Des chercheurs ont montré que le DGM est présent dans pas moins de 86 cas de sécheresse oculaire sur 100.5 L’étiologie exacte du DGM est inconnue. Il est clair, cependant, que deux pathologies semblent être la clé : la diminution de la couche lipidique due à la kératinisation de l’anatomie du conduit terminal et une accumulation de matériel cellulaire et lipidique à l’intérieur de la lamelle du conduit.13
Une grande partie de la recherche – et du développement de produits – s’est concentrée sur l’amélioration de la fonction de la glande de Meibomius en inversant ou en éliminant ces deux pathologies.
Approche clinique
Après avoir diagnostiqué un patient atteint de DED, les cliniciens doivent ensuite déterminer s’il s’agit d’un ADDE, d’un MGD ou (comme c’est fréquent) d’une combinaison des deux. Ensuite, il faut déterminer quel processus contribue le plus à la présentation et orienter son approche thérapeutique de manière appropriée.
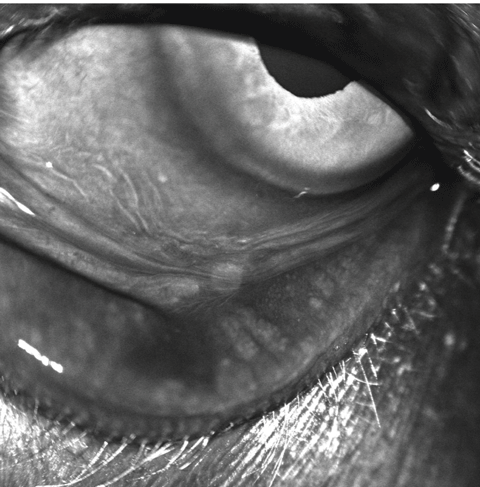
Ce patient présente clairement une chute des glandes meibomiennes. Cliquez sur l’image pour l’agrandir.
La plupart des patients qui présentent une sécheresse oculaire 2+ ont une expression minimale de l’huile des glandes de Meibomian, selon le rapport DEWS.3 Initialement, un diagnostic différentiel précis basé sur la coloration et l’expression des glandes de Meibomian peut être difficile à déterminer car le processus inflammatoire créera des résultats cohérents avec l’ADDE et la MGD. Trop souvent, cela peut induire en erreur et mettre le praticien et le patient sur la mauvaise voie de prise en charge si la cause sous-jacente est plus nettement l’ADDE que la MGD. Étant donné que les traitements pour ces deux diagnostics peuvent prendre des mois avant de produire des résultats, il est évidemment essentiel de poser le meilleur diagnostic initial avant de tenter un traitement à long terme.
L’utilisation initiale d’un stéroïde topique QID pendant deux à quatre semaines peut réduire l’inflammation, permettant au clinicien de poser un diagnostic initial plus précis et un plan de traitement initial. Le rapport de l’atelier international sur l’œil sec indique que, au moins dans certains cas, l’inflammation périglandulaire contribue à la MGD.3
Dans notre pratique, nous commençons généralement par une utilisation à court terme d’un stéroïde topique pour réduire l’inflammation dans et autour des glandes de Meibomius et aider à rétablir la libre circulation de l’huile via l’expression digitale. Si cela réussit, nous continuerons avec une confiance raisonnable dans le fait que le traitement de l’ADDE améliorera l’ensemble de la DED. Puisque ce patient souffre d’ADDE, notre régime médical consiste généralement à réduire progressivement les stéroïdes au cours du premier mois de traitement, à introduire la cyclosporine 0,5 % OU BID et à effectuer un suivi après trois mois. Ces patients reçoivent une éducation approfondie au moment du diagnostic sur la nature chronique de la maladie et comprennent qu’ils devront être traités et/ou suivis régulièrement.
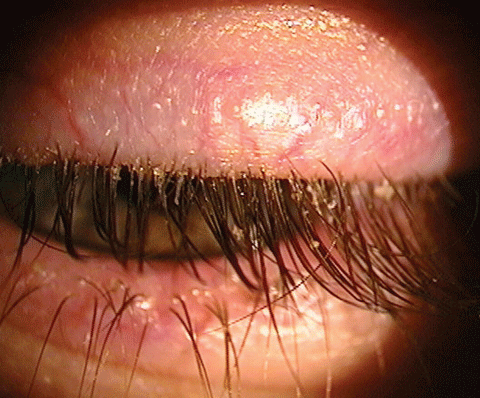
La blépharite est une infection inflammatoire qui peut entraîner une sécheresse oculaire. Plusieurs produits sur le marché visent à traiter cette affection. Cliquez sur l’image pour l’agrandir.
Lorsque la réduction de l’inflammation périglandulaire n’entraîne pas la levée souhaitée du blocage des glandes de Meibomius, nous agissons de manière plus agressive pour améliorer la production de la couche lipidique.
De nombreux praticiens initient un traitement à la fois avec un stéroïde et une ciclosporine topique. Une étude de 2012 indique que le traitement avec une combinaison de méthylprednisolone 1 % et de ciclosporine 0,5 % a permis d’améliorer les résultats cliniques à un mois par rapport aux patients traités avec la ciclosporine seule.14 Cela suggère que le traitement initial avec un stéroïde peut aider à mieux traiter la cause sous-jacente du processus inflammatoire.
Le gelotemax (étabonate de lotéprednol, Bausch + Lomb) est particulièrement utile dans cette phase initiale du traitement. Un avantage de la forme gel du médicament est que la suspension maintient une distribution égale de l’ingrédient actif dans tout le flacon sans avoir à agiter avant utilisation, ce que les patients sont susceptibles d’oublier avant d’instiller un collyre. Dans les véhicules d’administration de médicaments non gélifiés, cela peut entraîner une dilution du principe actif pendant la phase initiale de l’application et une sursaturation du principe actif vers la fin du traitement.
Thérapie au-delà du flacon
Plusieurs nouvelles options de traitement ont vu le jour récemment dans le but d’éliminer le besoin constant de gouttes, et les piliers comme l’occlusion ponctuelle continuent de jouer un rôle. Cependant, même avec le contrôle supplémentaire que ces interventions offrent, les patients atteints de DED doivent être informés qu’ils seront probablement traités à vie.
À moins que vous n’ayez un cabinet limité à l’œil sec, il est rare qu’un cabinet supporte l’achat de toutes les options disponibles. Ces produits sont à différents stades d’approbation par la FDA, mais chacun d’entre eux montre un certain degré de promesse pour le traitement de l’œil sec, et de la MGD en particulier.
Les bouchons ponctifs sont bien sûr utilisés depuis des années comme traitement de la DED, comme moyen de diminuer le drainage des larmes et de maintenir un volume lacrymal adéquat. Dextenza (Ocular Therapeutix), un nouveau développement prometteur dont le concept est similaire, bien qu’il ne s’agisse pas vraiment d’un bouchon ponctuel, est un dépôt de médicament intracanaliculaire qui libère dans le temps une dose progressive de dexaméthasone sur une période de quatre semaines. En évitant les variations importantes de la concentration du médicament, typiques des médicaments administrés par voie topique, cette approche à libération prolongée est censée fournir un traitement plus cohérent. Elle est actuellement en cours d’examen par la FDA.
BlephEx (Rysurg), une procédure en cabinet qui s’apparente à un gommage agressif des paupières, est une autre intervention prometteuse en matière de MGD. Bien que la blépharite ne soit pas la même chose que la MGD, sa présence peut également interférer avec les sécrétions des glandes de Meibomius. Ce traitement ressemble à une brosse à algues utilisée pour l’élimination des corps étrangers, mais utilise une micro-éponge au lieu d’une tête de diamant. BlephEx est une procédure réalisée par le clinicien pour exfolier les débris du bord de la paupière, généralement après l’application d’un anesthésique topique. Elle dure environ six à huit minutes.
Avenova (NovaBay) est une méthode d’hygiène des paupières plus récente à utiliser par le patient à domicile, bien qu’elle nécessite une prescription. Il contient une formulation stable d’acide hypochloreux à 0,01 % – la même molécule utilisée par les globules blancs pour inactiver les agents pathogènes – dans une solution saline dite conçue pour une utilisation quotidienne. Avenova a une activité à large spectre contre les micro-organismes courants des paupières, notamment Serratia marcescens, Staphylococcus aureus résistant à la méthicilline, Staphylococcus epidermis et Staphylococcus haemolyticus.16 Le patient pulvérise Avenova sur la surface des paupières, l’œil fermé, puis le masse doucement dans la paupière avec son doigt.
LipiFlow (TearScience), est un système de traitement par pulsation thermique visant à améliorer la mobilité du meibum. L’appareil délivre de la chaleur sur la paupière interne ainsi qu’une pression adaptative qui nettoie les glandes sans exercer de pression sur le globe. La procédure se fait de manière bilatérale au cabinet et prend environ 12 minutes pour susciter une expression de la glande de Meibomius. Elle peut être réalisée une seule fois ou répétée en fonction de la réponse du patient.
La thérapie par lumière pulsée intense (IPL) est approuvée par la FDA depuis plus de 15 ans pour traiter la rosacée et éliminer les lésions cutanées superficielles. On trouve couramment un tel appareil dans les cabinets de dermatologie.
![]()
En haut, perte structurelle importante de la glande de Meibomius chez un patient atteint de MGD modérée à sévère. En bas, l’aspect clinique de la surface oculaire et de la paupière dans le même œil. Cliquez sur l’image ci-dessous pour l’agrandir.
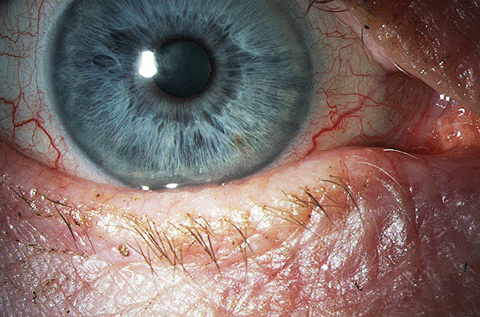
L’ophtalmologiste Rolando Toyos, MD, a eu l’idée d’utiliser la lumière pulsée dans les soins oculaires après qu’une série de patients atteints de DME se soient présentés dans son cabinet en démontrant une amélioration des caractéristiques du film lacrymal sans aucun changement dans leur régime de traitement – tous avaient été traités pour la rosacée avec la lumière pulsée15. L’appareil utilise une lampe flash au xénon pour émettre des longueurs d’onde de lumière de 400 nm à 1200 nm. Lorsqu’il est placé sur la lampe, un filtre restreint la longueur d’onde à la plage de lumière visible de 500 nm. Lorsqu’elle est appliquée sur la peau, cette bande de lumière provoque l’absorption de la lumière par les cellules sanguines des vaisseaux télangiectasiques, leur coagulation et, enfin, la fermeture des vaisseaux sanguins.16 Certaines études émettent l’hypothèse que le traitement par IPL près de la paupière provoque la fermeture des vaisseaux sanguins anormaux et notent un effet positif sur les patients atteints de MGD.
L’IPL est contre-indiquée chez les patients ayant une pigmentation plus foncée en ce sens que le pigment absorbe la lumière, ce qui la rend inefficace. Bien que la LIP soit prometteuse pour le traitement de la MGD, les lois sur le champ d’exercice peuvent entraver son utilisation généralisée par les optométristes. Toutefois, de nombreux conseils d’optométrie interprètent les lois de leur État comme autorisant l’utilisation de cette technologie dans le cadre de la pratique de l’optométrie. Avant de mettre en œuvre tout traitement IPL en cabinet, les cliniciens devraient vérifier auprès du conseil de leur État pour s’assurer qu’il n’y a pas de langage prohibitif qui empêcherait l’utilisation optométrique.
La gestion de la MGD dans la pratique clinique reste difficile, car l’observance des patients aux thérapies auto-administrées recommandées par le médecin est notoirement faible.17 Ainsi, pour fournir une gestion plus efficace de l’œil sec, les praticiens devraient étudier les options en cabinet qui peuvent offrir une amélioration clinique à la fois immédiate et indépendante de l’observance (ou du manque d’observance) du patient. Certains fabricants proposent une période d’essai afin de s’assurer que la démographie de leurs patients permet de supporter les dépenses supplémentaires et de couvrir les frais généraux initiaux. Une fois que vous aurez affiné la meilleure façon de traiter la DED dans votre population particulière, vous pourrez commencer à améliorer la qualité de leur vie pour les années à venir.
Le Dr Moore est instructeur clinique principal pour le Kentucky College of Optometry à Pikeville, KY, et est actuellement vice-président de l’Association of Regulatory Boards of Optometry.
1. Portée du marché. Rapport complet 2011 sur le marché mondial des produits pour les yeux secs. St. Louis, MO : Market Scope, novembre 2011.
2. National Eye Institute. Faits sur l’œil sec. www.nei.nih.gov/health/dryeye/dryeye. Consulté le 7 avril 2016.
3. La définition et la classification de la maladie de l’œil sec : Rapport du sous-comité de définition et de classification de l’atelier international sur l’œil sec (2007) Ocul Surf. 2007;5:75-92.
4. Kim KW, Han SB, Han ER, et al. Association entre la dépression et la maladie des yeux secs dans une population âgée. Invest Ophthalmol Vis Sci. 2011 Oct 10;52(11):7954-8.
5. Lemp M, Crews L, Bron A, et al. Distribution de l’œil sec déficient en eau et évaporatif dans une population de patients basée sur la clinique. Cornea. 2012 May;31(5):472-8.
6. The Gallup Organization, Inc. L’étude Gallup 2012 sur les personnes souffrant d’œil sec. Princeton, NJ : Multi-Sponsor Surveys, Inc ; 2012.
7. Doughty M, Fonn D, Richter D, et al. Une approche de questionnaire de patient pour estimer la prévalence des symptômes de l’œil sec chez les patients se présentant aux pratiques optométriques à travers le Canada. Optométrie et science de la vision. 1997;74(8):624-31.
8. Manaviat M, Rashidi M, Afkhami-Ardekani M, Reza Shoja M. Prévalence du syndrome de l’œil sec et de la rétinopathie diabétique chez les patients diabétiques de type 2. BMC Ophthalmology. 2008 June 2;8:10.
9. Leung E, Medeiros F, Weinreb R. Prevalence of ocular surface disease in glaucoma patients. J Glaucoma. 2008 Aug;17(5):350-5.
10. Trattler W, Reilly C, Goldberg D, et al. Cataracte et œil sec : Étude prospective d’évaluation de la santé des patients atteints de cataracte sur la surface oculaire. Réunion annuelle 2011 de l’American Society of Cataract and Refractive Surgery, San Diego, Calif.
11. Schaumberg DA, Sullivan DA, Buring JE, Dana MR. Prévalence du syndrome de l’œil sec chez les femmes américaines. Am J Ophthalmol. 2003 Aug ; 136(2):318-26.
12. Creech J, Do L, Fatt I, Radke C. In vivo tear film thickness and implications for tear film stability. Curr Eye Res. 1998 Nov 17(11)1058-66.
13. Tomlinson A, Bron A, Korb D. The International Workshop on Meibomian Gland Dysfunction : Rapport du sous-comité de diagnostic. Investigative Ophthalmology & Science visuelle. Mars 2011;52:2006-49.
14. Byun Y, Kim T, Kown S, et al. Efficacité d’un traitement combiné de ciclosporine à 0,05 % et de méthylprednisiline à 1 % pour l’œil sec chronique. Cornea, 2012 mai;31(5):509-13.
15. Papageorgiou P, Clayton W, et al. Traitement de la rosacée avec la lumière pulsée intense : Amélioration significative et résultats durables. Br J Dermatol 2008:159;3;628-32.
16. Toyos R, McGill W, Briscoe D. Traitement à la lumière pulsée intense pour la maladie des yeux secs due à la dysfonction des glandes de Meibomian ; une étude rétrospective de 3 ans. Photomed Laser Surg. 2015 Jan 1;33(1):41-6.
17. Geerling G, Tauber J, Baudouin C, et al. The International Workshop on Meibomian Gland Dysfunction : report of the subcommittee on management and treatment of meibomian gland dysfunction. Invest Ophthalmol Vis Sci. 2011 ; 52 : 2050-2064.