Les modifications cutanées associées aux maladies thyroïdiennes comprennent des lésions spécifiques telles que le kyste du canal thyroglosse et les métastases cutanées, des signes non spécifiques tels que ceux secondaires aux changements hormonaux dus à l’hyperfonctionnement et à l’hypofonctionnement, et des modifications dermatologiques associées aux maladies thyroïdiennes, dont nous fournissons deux exemples cliniques.
Le taux de prévalence de l’hypothyroïdie primaire auto-immune (PAIH) est de 5%, et jusqu’à 8,3% si l’on inclut l’hypothyroïdie subclinique1. Les manifestations cutanées associées à la PAIH comprennent un certain nombre de maladies cutanées communes aux patients atteints de cette affection (définies par la présence d’auto-anticorps même dans un état euthyroïdien) et d’autres dépendant directement de la fonction thyroïdienne.
Dans le premier groupe, la fréquence du dysfonctionnement thyroïdien est variable, se produisant chez 40 à 70 % des patients présentant des taches de mélanine de localisation centro-faciale, chez 42 % des hommes et 62 % des femmes atteints de vitiligo, chez 50 % des patients atteints de candidose cutanéo-muqueuse chronique, chez 34 % des patients atteints de dermatite herpétiforme, chez 8 % des réactions d’hypersensibilité retardée et chez 8 % des patients atteints d’alopécie areata. Les maladies thyroïdiennes auto-immunes sont également fréquemment associées au pemphigus et à d’autres maladies bulleuses, au lupus érythémateux systémique, à la sclérodermie, au sarcome de Kaposi, à l’érythème annulaire centrifuge, au granulome annulaire généralisé, réticulohistiocytose multicentrique, pseudoxanthome élastique, mucinose érythémateuse réticulaire, anémie (anémie pernicieuse, aplasie des globules rouges), herpès gestationnel, dermatomyosite, syndrome de Sjögren, polymyosite, autres maladies endocriniennes (acanthosis nigricans, néoplasie endocrinienne multiple, syndrome de McCune-Albright, syndrome de Sweet), syndrome de CREST (calcinose, syndrome de Raynaud, dysfonctionnement œsophagien, sclérodermie et télangiectasie), psoriasis, syndrome de Cowden avec hamartomes multiples, syndrome ANOTHER (alopécie, dystrophie unguéale, hypohydrose et éphélides), acropachies2 et manifestations atopiques telles que l’urticaire, le dermatographisme et l’œdème de Quincke3.3-5
Les modifications cutanées directement dépendantes de l’hypofonctionnement de la thyroïde comprennent :
- –
Typiquement une peau sèche, pâle et froide en raison de la diminution du flux capillaire, de la transpiration et de la thermogenèse ; une kératodermie palmoplantaire, qui peut se généraliser et se transformer en xérodermie, mais qui répond de façon spectaculaire au traitement substitutif.
- –
Kératose pilaire des follicules entraînant une alopécie permanente, des cheveux clairsemés et une perte latérale des sourcils. Elle peut être associée à un livedo reticularis des membres.6
- –
Myxœdème généralisé ou mucinose cutanée, dû à l’accumulation d’acide hyaluronique et de glycosaminoglycanes dans la peau. Cela provoque le faciès caractéristique de l’hypothyroïdie : peau épaisse, œdème périorbitaire et épaississement des muqueuses avec dysphonie. Il peut y avoir une hyperpigmentation périoculaire (signe de Jellinek)7 et une hypercaroténémie due à l’absence de métabolisme hépatique du carotène, qui s’accumule dans la couche cornée, est excrété dans la sueur et se dépose dans les zones riches en glandes sébacées.
- –
Une lésion peu fréquente liée à l’hypothyroïdie primaire et au syndrome polyglandulaire auto-immun de type I, l’érythème annulaire centrifuge, consiste en une éruption annulaire avec éclaircissement central survenant sur les fesses, les cuisses et la partie proximale des bras. L’examen histologique montre un infiltrat lymphocytaire périvasculaire dans le derme moyen et profond.8
- –
Le granulome annulaire et le lichen plan buccal, peu connus de la plupart des endocrinologues, peuvent également être associés à une hypothyroïdie. Deux cas sont rapportés ici, et leur relation avec la maladie thyroïdienne auto-immune est analysée.
Cas 1
Une patiente a été référée à l’âge de 41 ans pour une hypothyroïdie. Ses antécédents comprenaient une fille atteinte de vitiligo et de PAIH, et la patiente elle-même avait subi une chirurgie pour un mélanome in situ deux ans auparavant et était en rémission. Les tests de laboratoire demandés par le service de dermatologie ont révélé une PAIH subclinique (TSH : 8,7mcU/mL, FT4 : 0,92ng/dL, ATA-TPO : >1300U/mL) qui a été suivie à la clinique sans traitement. Neuf ans plus tard, la patiente a signalé une aphonie, une peau sèche et une asthénie avec des changements menstruels post-ménopausiques (TSH : 8,34mcU/mL, FT4 : 0,98ng/dL). Elle présentait un goitre de grade I avec une surface irrégulière et une image échographique hypoéchogène et pseudo-nodulaire de 8,7 mm au pôle supérieur du lobe gauche. Par la suite, elle a été traitée par lévothyroxine à des doses de 1,11 mcg/kg (TSH : 2,18 mcU/mL). Un an plus tard, des lésions papuleuses confluentes sont apparues à la face postérieure des deux jambes, sous le creux poplité. Les lésions ont été biopsiées et diagnostiquées comme des granulomes annulaires (Fig. 1a et b). Le patient a été traité avec des corticostéroïdes topiques sans amélioration des lésions et reçoit actuellement une PUVAthérapie (psoralènes et rayonnement ultraviolet A).
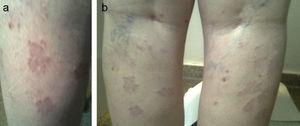
a et b. Granulome annulaire.
Le granulome annulaire est une lésion indurée, non squameuse, survenant habituellement dans les membres sous forme de plaques et de papules annulaires de la couleur de la peau. Il est considéré comme une dermatose chronique, bénigne et autolimitée, d’étiologie inconnue et caractérisée par une inflammation granulomateuse due à un mécanisme d’hypersensibilité de type IV de la peau. Une prédisposition génétique a été suggérée car elle a été liée aux haplotypes HLA-BW35 et HLA-A29. Le granulome annulaire a été associé à une thyroïdite auto-immune (dans 5,7 à 12 % des cas),9,10 au diabète sucré et à certains néoplasmes comme le lymphome de Hodgkin. Pour cette raison, les patients présentant un granulome atypique ou les personnes âgées doivent subir des tests pour exclure les tumeurs solides et hématologiques, ainsi que les états d’immunosuppression11. Certains auteurs postulent que son association avec la maladie thyroïdienne auto-immune peut être due au hasard en raison de sa forte prévalence, tandis que d’autres auteurs rapportent une association statistiquement plus fréquente qu’ils expliquent par une prédisposition génétique, un mécanisme physiopathologique auto-immun qui induit l’apoptose ou des facteurs déclenchants, communs aux deux affections.10 On pense que les kératinocytes, les cellules de Langerhans et les mélanocytes libèrent des cytokines qui stimulent les cellules inflammatoires. Parmi les quatre formes existantes (localisée, disséminée, linéaire perforante et sous-cutanée), le granulome annulaire généralisé, constitué de 10 lésions papuleuses ou plus tendant à la confluence annulaire, représente moins de 10 % des cas. La plupart des patients sont diagnostiqués entre la quatrième et la septième décennie de leur vie. Les lésions sont généralement situées de façon symétrique sur le tronc et les membres. L’examen pathologique révèle des granulomes en palissade avec une infiltration lymphocytaire périvasculaire et des lymphocytes T-helper prédominants. Chez plus de la moitié des patients, le granulome se résout spontanément sans traitement dans un délai de deux mois à deux ans, mais il peut récidiver dans jusqu’à 40 % des cas, en particulier chez les enfants, et peut parfois persister jusqu’à 10 ans. Aucun traitement n’est généralement nécessaire pour la forme localisée et autolimitée. Chez les patients qui demandent un traitement ou en cas de granulome généralisé9, des injections intralésionnelles de corticostéroïdes (triamcinolone 2,5-5mg/mL), la cryothérapie et l’électrodessication peuvent être tentées, après avoir averti les patients de l’apparition potentielle d’une atrophie ou de cicatrices12. Parmi les autres traitements utilisés, citons l’interféron bêta-1, la PUVA, l’acide rétinoïque, le tacrolimus, le laser et les traitements rétinoïdes par voie orale, la dapsone ou la ciclosporine.13
Cas 2
Il s’agissait d’une patiente de 50 ans aux antécédents familiaux et personnels sans particularité qui était suivie à la clinique d’endocrinologie depuis 1998 pour une HPI subclinique diagnostiquée à l’âge de 38 ans et pour laquelle aucun traitement n’avait été administré jusqu’en 2005. Les résultats des tests de laboratoire à la ménopause comprenaient : TSH, 22mcU/mL ; FT4, 0,81ng/dL ; et ATA-TPO, >1300U/mL. Le patient présentait un petit goitre élastique de grade I, sans signe clinique de dysfonctionnement hormonal ou de compression du cou. Un traitement de substitution a été instauré à une dose de 1,77mcg/dL. Le patient a signalé des lésions érosives et ulcéreuses de la muqueuse buccale depuis 2000. L’examen physique a révélé des lésions réticulaires blanchâtres sur les deux joues avec des érosions superficielles. Les tests de laboratoire, y compris la sérologie de l’hépatite C, étaient négatifs. Sur la base du diagnostic de lichen plan buccal, un traitement a été instauré avec des corticostéroïdes systémiques et topiques, des antipaludéens de synthèse et, enfin, après récidive à l’arrêt du traitement, de la ciclosporine orale. Lors de la dernière visite, les lésions de la muqueuse buccale persistaient à l’intérieur de la joue, et également sur la langue avec un motif géographique.
Le lichen plan est une éruption papuleuse, inflammatoire et prurigineuse d’évolution chronique affectant la peau et les muqueuses. Son taux de prévalence dans la population européenne adulte varie de 1 à 3 % et est plus fréquent chez les femmes d’âge moyen (50-59 ans).14,15 Il représente une réaction auto-immune médiée par les cellules T et dirigée contre les kératinocytes basaux qui expriment des auto-antigènes à leur surface et ont été modifiés par différentes causes. Les antigènes spécifiques qui déclenchent la réponse immunitaire ne sont pas clairs.14,16 Les déclencheurs potentiels signalés comprennent l’hépatite C, les médicaments, les allergènes de contact et les néoplasmes. Plusieurs cytokines pro-inflammatoires telles que les interleukines 2, 4, 6 et 10, le facteur de nécrose tumorale alpha, l’interféron alpha et le facteur de croissance transformant B1 ont été mises en cause. Il existe différentes formes cliniques. Le lichen plan buccal affecte le plus souvent la muqueuse jugale, mais peut également toucher la langue, les gencives, le palais et d’autres tissus muqueux et conjonctifs. La forme réticulaire avec des lésions blanchâtres entrelacées formant un réseau affectant symétriquement les deux côtés de la muqueuse jugale est la plus courante et est généralement asymptomatique. Il existe également une forme érosive avec des ulcères superficiels qui affectent généralement les faces latérales de la langue. Plus la durée du suivi est longue, plus l’évolution d’une forme simple vers une forme combinée est fréquente.16 On trouve des lésions cutanées chez 15 à 20 % des patients atteints de lichen plan buccal, et cette affection a été associée au développement de tumeurs buccales dans 1 à 5 % des cas.17
Une étude récente a examiné la base de données d’un service de santé comprenant 1477 patients atteints de lichen plan et 2856 témoins. Plusieurs caractéristiques cliniques et démographiques ont été analysées, et une association statistiquement significative a été trouvée avec l’hypothyroïdie et la dyslipidémie.18
Dans une étude finlandaise publiée en septembre 2010, après avoir examiné les antécédents cliniques de 222 patients atteints de lichen plan et de 222 témoins, une prévalence de 15 % de maladie thyroïdienne a été trouvée chez ceux qui en étaient atteints, indépendamment du traitement à la lévothyroxine. Jusqu’à un tiers des cas présentaient un lichen plan sur la muqueuse buccale et la langue, comme c’est le cas chez le patient rapporté. Une maladie thyroïdienne antérieure est associée à un risque deux fois plus élevé d’avoir un lichen plan buccal.6 La résolution spontanée complète est rare.16 Des rémissions spontanées au cours de la première année ont été signalées, mais une récurrence ultérieure survient dans 20 % des cas. Le traitement a été tenté avec des corticostéroïdes oraux, la PUVA, des rétinoïdes, l’énoxaparine sodique, la sulfasalazine, le métronidazole et des thérapies biologiques comme l’alefacept, l’efalizumab et le basiliximab, avec des résultats variables. Des études d’efficacité portant sur un plus grand nombre de patients sont encore nécessaires. Par conséquent, étant donné que la régression spontanée se produit dans certains cas et que les traitements ont de nombreux effets secondaires, le rapport risque-bénéfice doit toujours être évalué avant de commencer le traitement.19
En résumé, nous rapportons les cas cliniques de deux patients présentant une PSIH et des lésions cutanées paucisymptomatiques qui doivent être prises en compte lors de l’anamnèse et de l’examen physique, car elles peuvent être traitées et nécessitent une surveillance en raison de leur risque potentiel de malignisation.