Contenu
- 1 Introduction
- 2 Cristallisation et diffraction des rayons X
- 3 Structure
- 4 Fonction
- 5 Maladies
- 6 Structures 3D de la myosine
- La myosine est un élément essentiel de la santé.rayonnements
- 3 Structure
- 4 Fonction
- 5 Maladie
- 6 Structures 3D de la myosine
Introduction
La myosine est l’une des trois grandes classes de protéines motrices moléculaires : la myosine, la dynéine et la kinésine. En tant que la plus abondante de ces protéines, la myosine joue un rôle structurel et enzymatique dans la contraction musculaire et la motilité intracellulaire. La myosine a été découverte pour la première fois dans le muscle au 19e siècle. La myosine est une superfamille de protéines qui lient l’actine, hydrolysent l’ATP et transforment la force. Ainsi, la plupart sont situées dans les cellules musculaires. Composée de domaines de tête, de cou et de queue. Le domaine tête se lie à l’actine et se déplace le long de celle-ci. Le cou est un lieur et lie les chaînes légères qui ont une fonction de régulation. La queue interagit avec les molécules cargo (CBD)m. Il existe 18 classes de myosine.
Les myosines non conventionnelles ne formeraient pas de filaments.
- La myosine II (MII) est la mieux étudiée. Elle pilote la motilité à grande vitesse comme la contraction musculaire. La MII contient 2 chaînes lourdes (HC) qui constituent le domaine de tête ou moteur (MD) et le domaine de queue et 4 chaînes légères (LC) qui sont appelées LC essentielle (ELC) et LC régulatrice (RLC).
- La myosine III (MIII) contient un domaine kinase C-terminal connecté au domaine moteur.
- La myosine V (MV) travaille avec des moteurs basés sur les microtubules comme la kinésine.
- La myosine VI (MVI) se déplace vers l’extrémité négative du filament d’actine.
- La myosine VII (MVII) a une courte queue et peut agir dans le mouvement des membranes intracellulaires.
- La myosine X (MX) est un effecteur en aval de la PI(3)K pendant la phagocytose.
- La myosine XI (MXI) relie la membrane nucléaire au cytosquelette.
Voir aussi Myosine (hébreu).
Cristallisation et diffraction des rayons X
La myosine se trouve en abondance, elle peut donc être préparée en quantité de grammes. Pendant près de 30 ans, la tête de la myosine a résisté à la cristallisation, pourtant, en 1993, les chercheurs ont découvert un mécanisme permettant d’obtenir des cristaux de qualité radiographique. Le processus a modifié la protéine par méthylation réductrice. Les données radiographiques ont été utilisées pour déterminer la structure tertiaire de la protéine.
Structure
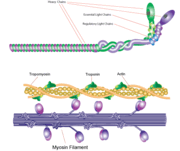
Myosin filament
La myosine a une taille moléculaire d’environ 520 kilodaltons avec un total de six sous-unités. Elle possède deux chaînes lourdes de 220 kD qui constituent la majorité de la structure globale et deux paires de chaînes légères dont la taille varie. La molécule est asymétrique, avec une longue queue et deux têtes globulaires. Chaque chaîne lourde compose la majeure partie de l’une des têtes globulaires. Le sous-fragment 1 (S1), également appelé tête de myosine, est constitué d’ATP, d’actine et de deux sites de liaison des chaînes légères. Chaque tête globulaire possède une chaîne lourde et deux chaînes légères pour une taille moléculaire combinée d’environ 130 kD.
La tête de myosine est asymétrique avec une longueur de 165 Angstroms et une largeur de 65 Angstroms, avec une épaisseur totale d’environ 40 Angstroms. Environ 48% des résidus d’acides aminés de la tête de la myosine sont dominés par des hélices α. À l’extrémité carboxyle, une longue hélice α d’environ 85 Angstroms s’étend en une bobine gauche. Cette hélice particulière forme la région de liaison de la chaîne légère du domaine globulaire L’extrémité amino-terminale de chaque chaîne lourde possède un grand domaine globulaire contenant le site d’hydrolyse de l’ATP.
Fonction
Les molécules de myosine s’agrègent dans les cellules musculaires pour former des filaments épais. La structure en bâtonnet de ces filaments épais joue le rôle de noyau dans l’unité contractile du muscle. L’agrégation de plusieurs centaines de myosine forme une structure bipolaire qui s’empile en réseaux réguliers. Les muscles sont constitués d’une autre protéine appelée actine. L’actine forme le filament fin des fibres musculaires. La myosine et l’actine interagissent par des liaisons faibles. Sans ATP, la tête de la myosine se lie étroitement à l’actine. Une fois l’ATP lié, la myosine libère la sous-unité d’actine et interagit avec une autre sous-unité plus loin dans le filament fin. Ce processus se poursuit en cycle, produisant un mouvement. L’interaction de la myosine et de l’actine est régulée par deux autres protéines, la tropomyosine et la troponine.
Le cycle d’interaction myosine-actine est décrit comme suit :
1. L’ATP se lie à la myosine et un site de liaison s’ouvre sur la tête de la myosine pour perturber l’interaction actine-myosine, l’actine est libérée. L’ATP est hydrolysée
2. Un changement de conformation déplaçant la protéine vers un état de « haute énergie » entraîne un changement d’orientation de la tête de la myosine la déplaçant pour qu’elle se lie avec la sous-unité d’actine plus proche de la région appelée disque Z que la sous-unité d’actine précédente
3. Le site de liaison est fermé, renforçant la liaison myosine-actine
4. un suit rapidement et la tête de la myosine subit un changement de conformation supplémentaire la ramenant à l’état de repos dans lequel elle a commencé
Cliquez sur le lien pour accéder à la vidéo DNAtube « A Moving Myosin Motor Protein »
http://www.dnatube.com/video/389/A-Moving-Myosin-Motor-Protein-myosin-actin-interaction
Maladie
Les mutations dans MIIA provoquent une myopathie précoce. Les mutations dans MVIIA provoquent le syndrome d’Usher.
Structures 3D de la myosine
Structures 3D de la myosine
.