| Attribut géométrique | héliceα-.hélice | 310 hélice | π-hélice |
|---|---|---|---|
| Résidus par tour | 3.6 | 3,0 | 4,4 | Translation par résidu | 1,5 Å (0,15 nm) | 2,0 Å (0,20 nm) | 1,1 Å (0,11 nm) | Radius de l’hélice | 2.3 Å (0,23 nm) | 1,9 Å (0,19 nm) | 2,8 Å (0,28 nm) | Pitch | 5,4 Å (0,54 nm) | 6,0 Å (0,60 nm) | 4,8 Å (0.48 nm) |
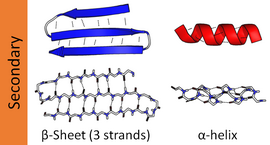
Diagramme interactif des liaisons hydrogène dans la structure secondaire des protéines. Dessin animé au-dessus, atomes en dessous avec l’azote en bleu, l’oxygène en rouge (PDB : 1AXC)
Les structures secondaires les plus courantes sont les hélices alpha et les feuillets bêta. D’autres hélices, telles que l’hélice 310 et l’hélice π, sont calculées pour avoir des modèles de liaison hydrogène énergétiquement favorables, mais sont rarement observées dans les protéines naturelles, sauf aux extrémités des hélices α en raison d’un emballage défavorable du squelette au centre de l’hélice. D’autres structures étendues, telles que l’hélice de polyproline et le feuillet alpha, sont rares dans les protéines à l’état natif mais sont souvent considérées comme des intermédiaires importants du repliement des protéines. Des virages serrés et des boucles souples et lâches relient les éléments de structure secondaire les plus « réguliers ». La bobine aléatoire n’est pas une véritable structure secondaire, mais constitue la classe de conformations qui indiquent une absence de structure secondaire régulière.
Les acides aminés varient dans leur capacité à former les divers éléments de structure secondaire. La proline et la glycine sont parfois connues sous le nom de « briseurs d’hélice » parce qu’elles perturbent la régularité de la conformation du squelette α hélicoïdal ; cependant, toutes deux ont des capacités conformationnelles inhabituelles et sont couramment trouvées dans les tours. Les acides aminés qui préfèrent adopter des conformations hélicoïdales dans les protéines comprennent la méthionine, l’alanine, la leucine, le glutamate et la lysine (« MALEK » dans les codes à 1 lettre des acides aminés) ; en revanche, les grands résidus aromatiques (tryptophane, tyrosine et phénylalanine) et les acides aminés à ramification Cβ (isoleucine, valine et thréonine) préfèrent adopter des conformations en brin β. Cependant, ces préférences ne sont pas assez fortes pour produire une méthode fiable de prédiction de la structure secondaire à partir de la séquence seule.
Les vibrations collectives à basse fréquence sont censées être sensibles à la rigidité locale au sein des protéines, révélant que les structures bêta sont génériquement plus rigides que les protéines alpha ou désordonnées. Des mesures de diffusion de neutrons ont directement relié la caractéristique spectrale à ~1 THz aux mouvements collectifs de la structure secondaire de la protéine GFP à barillet bêta.
Les motifs de liaison hydrogène dans les structures secondaires peuvent être considérablement déformés, ce qui rend difficile la détermination automatique de la structure secondaire. Il existe plusieurs méthodes pour définir formellement la structure secondaire des protéines (par exemple, DSSP, DEFINE, STRIDE, ScrewFit, SST).
Classification DSSPÉditer

Le Dictionnaire de la structure secondaire des protéines, en abrégé DSSP, est couramment utilisé pour décrire la structure secondaire des protéines avec des codes à une seule lettre. La structure secondaire est attribuée en fonction des modèles de liaison hydrogène tels que ceux initialement proposés par Pauling et al. en 1951 (avant qu’aucune structure de protéine n’ait jamais été déterminée expérimentalement). Il existe huit types de structure secondaire que le DSSP définit :
- G = hélice à 3 tours (hélice 310). Longueur minimale 3 résidus.
- H = hélice à 4 tours (hélice α). Longueur minimale 4 résidus.
- I = hélice à 5 tours (hélice π). Longueur minimale 5 résidus.
- T = tour lié à l’hydrogène (3, 4 ou 5 tours)
- E = brin étendu en conformation β-feuillets parallèles et/ou antiparallèles. Longueur minimale de 2 résidus.
- B = résidu en β-pont isolé (formation d’une seule paire de liaison hydrogène β-feuille)
- S = virage (la seule affectation non basée sur une liaison hydrogène).
- C = serpentin (résidus qui ne sont dans aucune des conformations ci-dessus).
Le terme « serpentin » est souvent codifié par ‘ ‘ (espace), C (serpentin) ou ‘-‘ (tiret). Les hélices (G, H et I) et les conformations en feuille sont toutes tenues d’avoir une longueur raisonnable. Cela signifie que deux résidus adjacents dans la structure primaire doivent former le même motif de liaison hydrogène. Si le motif de liaison hydrogène de l’hélice ou du feuillet est trop court, il est désigné par T ou B, respectivement. D’autres catégories d’affectation de la structure secondaire des protéines existent (virages serrés, boucles Oméga, etc.), mais elles sont moins fréquemment utilisées.
La structure secondaire est définie par la liaison hydrogène, donc la définition exacte d’une liaison hydrogène est critique. La définition standard de la liaison hydrogène pour la structure secondaire est celle de DSSP, qui est un modèle purement électrostatique. Il attribue des charges de ±q1 ≈ 0,42e au carbone carbonyle et à l’oxygène, respectivement, et des charges de ±q2 ≈ 0,20e à l’hydrogène amide et à l’azote, respectivement. L’énergie électrostatique est
E = q 1 q 2 ( 1 r O N + 1 r C H – 1 r O H – 1 r C N ) ⋅ 332 kcal/mol . {\displaystyle E=q_{1}q_{2}\left({\frac {1}{r_{\mathrm {ON} }}}+{\frac {1}{r_{\mathrm {CH}}} }}-{\frac {1}{r_{\mathrm {OH}}-{\frac {1}{\r_{\mathrm}}}. }}-{\frac {1}{r_{\mathrm {CN}} }}\right)\cdot 332{\text{ kcal/mol}}.}

Selon la DSSP, une liaison hydrogène existe si et seulement si E est inférieur à -0,5 kcal/mol (-2,1 kJ/mol). Bien que la formule DSSP soit une approximation relativement grossière de l’énergie physique de la liaison hydrogène, elle est généralement acceptée comme outil de définition de la structure secondaire.
Classification SSTEdit
La SST est une méthode bayésienne permettant d’attribuer une structure secondaire aux données de coordonnées des protéines en utilisant le critère d’information de Shannon de l’inférence de longueur minimale de message (LMM). SST traite toute affectation de structure secondaire comme une hypothèse potentielle qui tente d’expliquer (compresser) des données de coordonnées de protéines données. L’idée centrale est que la meilleure affectation de structure secondaire est celle qui peut expliquer (compresser) les coordonnées d’une protéine donnée de la manière la plus économique, reliant ainsi l’inférence de structure secondaire à la compression de données sans perte. SST délimite avec précision toute chaîne de protéines en régions associées aux types d’affectation suivants :
- E = brin (étendu) d’un feuillet β-plissé
- G = hélice droite 310
- H = hélice α droite
- I = hélice π droite
- g = hélice gauche 310
- h = hélice gauche.gauche
- i = hélice π gauche
- 3 = virage en 310
- 4 = virage en α
- 5 = virage en π
- T = virage non spécifié
- C = bobine
- – = résidu non attribué
.