Perché le reazioni avvengono a velocità diverse? Perché alcune avvengono rapidamente e altre procedono molto lentamente? Perché la stessa reazione potrebbe procedere a velocità diverse in condizioni diverse? Ci sono una serie di fattori che influenzano i tassi di reazione, ma questo articolo si concentra sulla barriera di attivazione.
Una barriera di attivazione è una sorta di ostacolo energetico che una reazione deve superare. Alcune reazioni hanno ostacoli più alti e altre hanno ostacoli più bassi. È più facile superare gli ostacoli più bassi, così le reazioni con basse barriere di attivazione possono procedere più rapidamente di quelle con barriere di attivazione più alte:
- Una bassa barriera di attivazione permette ad una reazione di avvenire rapidamente.
- Un’alta barriera di attivazione fa procedere una reazione più lentamente.
Una reazione può essere complessivamente esergonica, ma avere ancora una barriera di attivazione all’inizio. Anche se il sistema diminuisce di energia alla fine della reazione, generalmente sperimenta un aumento iniziale di energia.
-
Anche se una reazione emette complessivamente energia, l’energia deve essere aggiunta inizialmente per far partire la reazione.
Questa situazione è simile all’investimento in un business. Un’impresa richiede generalmente un investimento finanziario per iniziare. Se l’azienda ha successo, alla fine produrrà prodotti e restituirà i soldi agli investitori. Se l’azienda non è in grado di recuperare il suo investimento iniziale, può fallire.
Le reazioni richiedono un investimento iniziale di energia. Questa energia può provenire dalle molecole circostanti o dall’ambiente in generale. Se la reazione ha successo, procederà a fare prodotti ed emetterà energia nell’ambiente circostante.
- E’ sempre “costoso” per una molecola entrare in una reazione; “prende in prestito” quell’energia dal suo ambiente.
- Quell’investimento iniziale di energia può essere “ripagato” mentre la reazione procede.
Tutte le reazioni devono superare barriere di attivazione per poter avvenire. La barriera di attivazione è la somma dell’energia che deve essere spesa per far avvenire la reazione. Una barriera di attivazione è spesso immaginata come una collina che i reagenti devono scalare durante la reazione. Una volta lì, possono scivolare giù dall’altro lato della collina per diventare prodotti. In cima alla collina, la molecola esiste in quello che viene chiamato “stato di transizione”. Allo stato di transizione, la struttura è da qualche parte tra la sua forma originale e la struttura dei prodotti.
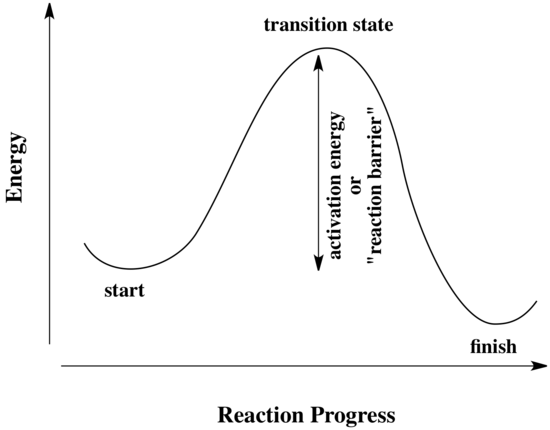
Il tipo di diagramma mostrato sopra è talvolta chiamato “diagramma di progresso della reazione”. Mostra i cambiamenti di energia nel sistema mentre una reazione procede. Una o più barriere di attivazione possono esistere lungo i percorsi di reazione, a causa di vari passi elementari nella reazione.
Per capire più concretamente i termini “progresso della reazione” e “stato di transizione”, consideriamo una reazione reale. Supponiamo che un nucleofilo, come uno ione acetilide, doni i suoi elettroni a un carbonile elettrofilo. Il legame π si rompe e si forma uno ione alcossido.

Il “progresso della reazione” si riferisce a quanto la reazione è andata avanti. Lo stato di transizione si riferisce specificamente al punto di massima energia sul percorso dai reagenti ai prodotti. Si riferisce alla struttura in quel punto, e all’energia associata a quella struttura.
Nel seguente diagramma, il termine “progresso della reazione” è stato sostituito da un’illustrazione che corrisponde allo stato della reazione con il punto corrispondente nella curva di energia. La struttura tra le parentesi quadre è lo stato di transizione, corrispondente al massimo della curva. Il simbolo del “doppio pugnale” indica una struttura di stato di transizione.
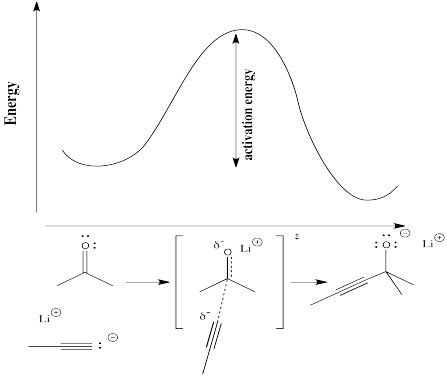
Lo stato di transizione non è una vera struttura chimica. Non obbedisce necessariamente alle regole delle strutture di Lewis, perché alcuni nuovi legami hanno iniziato a formarsi e alcuni vecchi legami hanno iniziato a rompersi; i legami parziali non hanno posto in una struttura di Lewis.
Fisicamente, la struttura dello stato di transizione non può essere isolata. Poiché si trova in cima a una curva di energia, lo stato di transizione tende a convertirsi in qualcos’altro. Un cambiamento in una delle due direzioni abbasserà la sua energia. La tendenza è quella di procedere verso l’energia più bassa, se possibile. Non appena lo stato di transizione si forma, o scivola indietro nei materiali di partenza originali o scivola in avanti nei prodotti finali.
-
Lo stato di transizione è intrinsecamente una struttura ad alta energia e instabile con una vita molto breve. Non appena si forma, scompare.
Contribuenti e attribuzioni
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)