INTRODUZIONE
I virus del papilloma umano (HPV) costituiscono un gruppo virale eterogeneo; il loro genoma è costituito da una molecola di DNA elicoidale a doppio filamento con un capside proteico. Sono costituiti da entità epiteliotropiche che infettano lo stato basale dell’epitelio e, di conseguenza, conservano la trascrizione e replicazione del DNA a livelli basali, producendo lesioni papillomatose e verrucose iperplastiche nella pelle e nelle mucose.1
Esistono più di 230 tipi di HPV (118 dei quali ben caratterizzati) e più di 40 tipi anali-genitali, dei quali 15 sono oncogeni. Nell’uomo, rappresentano uno dei gruppi virali che infettano più frequentemente gli epiteli della pelle e delle mucose congiuntive, il cavo orale (genotipi 33 e 32), la laringe, l’albero bronchiale, l’esofago, la vescica, l’ano e il tratto genitale.2,3
Nel caso dell’HPV della lingua, ci sono due gruppi principali di presentazione clinica:
a) lesioni benigne e b) lesioni pre-maligne o maligne. Tra le lesioni orali benigne possiamo trovare il papilloma orale, la verruca vulgaris orale (verruca comune), il condiloma acumina orale e l’iperplasia epiteliale focale (malattia di Hecks).4-6 Le lesioni maligne e pre-maligne sono rappresentate principalmente dalla leucoplachia e dal carcinoma a cellule squamose.7
Il papilloma squamoso della mucosa orale è la lesione papillare più frequentemente riscontrata, rappresenta il 2,5% o tutte le lesioni riscontrate nella bocca.6 Le lesioni cliniche da HPV si osservano più frequentemente nel labbro superiore, nel labbro inferiore, nel frenulo linguale, nel dorso della lingua e negli angoli delle labbra.8
La morfologia più comunemente osservata di queste lesioni assume una forma a cavolfiore, tuttavia, si possono osservare altre forme come verruche comuni, ipercheratosi o anche superfici non cheratinizzate, che presentano cambiamenti di colore superficiali (normalmente una tonalità viola).9 Secondo i riferimenti bibliografici, questa malattia viene trasmessa principalmente attraverso una pratica sessuale orale-genitale.10
Lo scopo del presente studio è stato quello di condurre una revisione della letteratura sulla papillomatosi orale e di riportare un caso clinico.
ISTOLOGIA DELLA LINGUA
Le cellule situate nella lingua presentano una disposizione strutturale polistratificata. Sono insediate su uno strato corneo (superficiale), uno strato granulare, uno strato spinoso e uno strato basale (strato più profondo). Il nucleo di queste cellule cambia di dimensione secondo la loro maturità e specializzazione.11
GENOMA DEL VIRUS DEL PADELLOMA
Le particelle virali sono composte da un capside proteico che è composto per il 95% dalla proteina L1 e per il 5% dalla proteina L2. Queste proteine si collegano per formare dei capsomeri icosaedrici. Il DNA circolare a doppio filamento di circa 8000 paia di basi si trova all’interno del capside. È formato da otto geni e da una regione regolatrice non codificata; questa regione contiene siti di collegamento per i fattori ormonali e proteici dell’ospite, necessari al virus per completare il suo ciclo di replicazione.12
Il virusHPV è similmente conformato da due tipi di geni: geni codificati durante le prime fasi dell’infezione, meglio conosciuti come geni E (E per early) e geni codificati durante le ultime fasi della replicazione conosciuti: E1, E2, E4, E5, E6, E7 (anche se E4 è considerato un gene tardivo) oltre a due geni tardivi, L1 e L2. I geni precoci codificano proteine coinvolte nella replicazione e regolazione virale, così come nella loro capacità cancerogena. D’altra parte, i geni tardivi codificano proteine strutturali che formano il capside virale.12,13
CICLO DI VITA dell’HPV
L’HPV entra nell’ospite attraverso una piccola abrasione nell’epitelio integrale della lingua.13 Poi inizia il suo ciclo produttivo infettando le cellule poco differenziate degli strati basali dell’epitelio, dove inizia la trascrizione dei geni.12
Quando le cellule infettate si differenziano e migrano dallo strato basale allo strato spinoso dell’epitelio (ammissibilità immunologica), la replicazione virale viene stimolata producendo così l’accumulo del virione nel nucleo e l’assemblaggio del capside nel citoplasma. Esistono almeno due cicli di replicazione virale: a) infezione litica e b) infezione lisogena.
Nei casi di infezione litica, il virus arriva nelle cellule para-basali con capacità di replicazione, penetra nel citoplasma e successivamente nel nucleo. Una volta all’interno del nucleo, si replica nella zona episomale, senza integrarsi nel genoma cellulare, producendo così circa 20 copie virali. Queste particelle virali complete causano la morte cellulare e rimangono così libere e in prossimità delle superfici epiteliali.
Nei casi di infezione lisogenica il genoma cellulare è direttamente interessato. Questo è il caso degli HPV ad alto rischio (16 e 18). Dopo aver raggiunto il nucleo della cellula, il virus si integra nel genoma cellulare dell’ospite, principalmente nei segmenti E6 ed E7. In questo caso, la replicazione del virus assume una fase di latenza fino a quando la cellula ospite replica il proprio DNA e il DNA dei virus integrati. I segmenti del DNA virale sono trascrizionalmente attivi dopo la divisione cellulare; questo garantisce la loro propagazione13 A differenza dei casi di infezione litica, questo tipo di infezione si osserva nelle cellule che subiscono una crescita maligna.
L’espressione genica dei diversi tipi di HPV è strettamente e specificamente regolata attraverso fattori di trascrizione come AP-1, fattore specifico dei cheratinociti, NF-1CTF, CEFI, CEFII e TEFI, nonché alcuni fattori di origine ormonale.
In entrambi i tipi di infezione, le proteine E1 ed E2 iniziano la loro espressione in direzione ascendente (sovraregolazione), attivando così la trascrizione del DNA e l’espressione controllata dalle cellule basali.12
I geni E6 ed E7 dell’HPV sono direttamente legati alla trasformazione maligna delle cellule attraverso le oncoproteine E6 ed E7. Queste proteine sono in grado di formare composti con prodotti genici cellulari che regolano il ciclo cellulare, tra cui p53 e Rb. L’oncoproteina E6 crea un composto con la proteina p53, mentre la E7 crea un composto con la proteina Rb.
La proteina Rb regola il passaggio da G1 a S L’oncoproteina E7 sequestra la Rb impedendole di regolare le proteine di proliferazione cellulare, questo costringe il ciclo cellulare a rimanere nella fase di sintesi.13 Questi due eventi: integrazione del gene virale nel genoma cellulare e blocco della normale funzione dei geni soppressori tumorali p53 e Rb sono associati alla trasformazione cellulare delle cellule infettate da virus ad alto potenziale oncogenico (16 e 18). I cambiamenti progressivi sperimentati dai cheratociti modificano il microambiente e alterano l’equilibrio dell’epitelio attraverso stimoli di proliferazione cellulare guidati dalla secrezione di fattori di crescita epidermica alfa e beta.
Le proteine E2, E3, E4, E5, E6 ed E7 inducono la perdita di controllo delle proteine geniche (DNA episomale al centro del nucleo) mentre E6 ed E7 replicano il DNA virale. L1 e L2 assemblano il virus e si posizionano nelle cellule squamose mature per poi slough off (oltre 1.000 copie per cellula).
Nelle lesioni benigne, come il papilloma della lingua, la proliferazione delle particelle di DNA episomale promuove una crescita anomala dell’epitelio, aumentando così gli errori genici delle cellule (gastogenesi).
E6 ed E7 promuovono la proliferazione e l’immortalizzazione del virus. Quando il virus possiede un potenziale oncogeno provoca la malignizzazione, quando non lo fa, si sviluppa una lesione benigna che può autolimitarsi in un periodo di due anni. Questo meccanismo è principalmente indotto dalla perdita dei telomeri del DNA, che inibisce l’apoptosi, aumenta il numero di cellule infettate e diminuisce l’acetilazione e la fosforilazione di p53 e Rb. Inoltre, viene promossa l’espressione dei fattori angiogenici. È il caso del fattore di crescita vascolare che disorganizza il citoscheletro cellulare e la matrice extracellulare influenzando i fattori di regolazione che partecipano alla salute di queste strutture.12
L’infezione daHPV causa importanti cambiamenti nella morfologia cellulare. Per esempio, si osserva la formazione di vacuoli peri-nucleari, nuclei allargati, irregolari e ipercromatici e la bi-nucleazione. Le cellule che hanno subito questi cambiamenti sono chiamate koylocytes e sono considerate “l’impronta digitale” del virus.
Il condiloma è la manifestazione morfologica più comune dell’infezione da HPV (condiloma acuminato).14
Presentazione del caso
La paziente era una donna single di 21 anni. Non lavorava fuori casa, era nata e risiedeva nell’Estado de Mexico (Stato del Messico). Il suo gruppo sanguigno era O, Rh positivo. Come parte della sua storia familiare ha riferito che suo padre era affetto da sclerosi multipla e una sorella da artrite reumatoide. La paziente ha negato qualsiasi dipendenza da droghe. Era afflitta da fibroadenoma mammario giovanile multiplo nel seno sinistro, che è stato trattato chirurgicamente. Ha iniziato il menarca a 15 anni, con ritmo mestruale 28 × 3. L’attività sessuale è iniziata a 17 anni. Ha riferito un partner sessualmente attivo, ha negato la pratica del sesso orale-genitale. Ha avuto una gravidanza e ha partorito un bambino vivo di 3,1 kg.
Un anno prima era stata sottoposta a studi di citologia e colposcopia nel tratto genitale inferiore, oltre al controllo del seno. I risultati sono stati negativi per il cancro e l’HPV. Il metodo di pianificazione familiare utilizzato dalla paziente era il dispositivo intrauterino.
La paziente ha chiesto la prima consultazione nell’aprile 2014, lamentando una glossodinia ventrale con un’evoluzione di tre mesi. In seguito, ha sperimentato una sensazione di corpo estraneo e di rigonfiamento nei tessuti molli, con una progressiva crescita centrifuga fino alla formazione di un tumore a forma di lenticchia che sanguinava al contatto con il palato duro e durante la masticazione. Si è recata presso uno studio medico dove ha ricevuto un trattamento sistemico non specificato che non ha dato risultati soddisfacenti.
La bocca è stata ispezionata attraverso una procedura di colposcopia con ingrandimento 0,66x (colposcopio Hinselmann, 2014 Messico). Tale procedura ha rivelato una lesione di circa 1 cm di diametro, di colore rosato, di forma circolare, con bordi frastagliati, senza peduncolo e di natura avascolare (Figura 1). Una volta completato lo studio, il paziente è stato informato della diagnosi e del trattamento auspicabile.
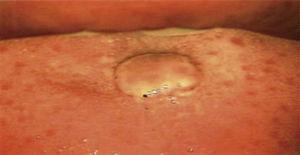
Ispezione diretta della bocca in prospettiva colposcopica. I (Hinselmann, 2014), con ingrandimento 0,66. Lesione che misura 1cm di diametro, di tonalità rosata, forma circolare, bordi frastagliati, avascolare e senza peduncolo.
TREATMENT
In anestesia locale e xilocaina al 2% con epinefrina (1mL) la base della lesione è stata infiltrata con un ago calibro 30G. La superficie della lesione è stata tagliata e sezionata con una dissezione a cuneo. Dopo aver ottenuto l’emostasi, i bordi sono stati affrontati (Dermalon 000) in un piano con suture invertite. Il campione ottenuto è stato fissato in 5 ml di formalina al 10% per poi essere inviato al Dipartimento di Patologia. Quindici giorni dopo le suture sono state rimosse e l’area chirurgica sana è stata così ottenuta (Figura 2). Il rapporto istopatologico ha rivelato la presenza di tessuto con misure di 0,6 × 0,5 cm. Il campione era di forma irregolare, di colore marrone scuro e di consistenza morbida. L’analisi al microscopio ha rivelato epitelio corneale poli-stratificato, acantosi e ipercheratosi. L’interno del campione ha rivelato focolai di cornificazione intra-epiteliale di diverse dimensioni. In generale, le cellule epiteliali erano di dimensioni inferiori a quelle dello strato spinoso normale (Figure 3 e 4). La diagnosi finale indicava un papilloma squamoso della lingua. La tipizzazione genica virale condotta con la reazione a catena della polimerasi (PCR) in tempo reale ha riportato la presenza di un genotipo 58 (virus ad alto rischio).
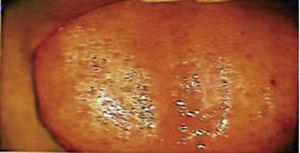
Fotografia della lingua in prospettiva colposcopica 15 giorni dopo l’intervento.
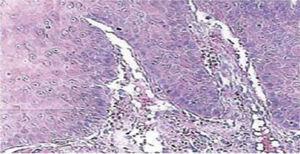
Ingrandimento microscopico 10x. Epitelio corneo poli-stratificato, acantosi e ipercheratosi.
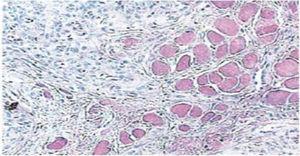
40 x ingrandimento microscopico. Focolai di cornificazione intraepiteliale di diverse dimensioni.
DISCUSSIONE
HPV è un virus del DNA; appartiene alla famiglia dei papovaviridae, del genere papillomavirus. Sono stati descritti più di 230 genotipi. Il periodo di incubazione varia da tre settimane a otto mesi, con una media di tre mesi. Dei 230 genotipi di papillomavirus, 16 sono più frequentemente associati a lesioni orali (1, 2, 3, 4, 6, 7, 10, 11, 13, 16, 31, 32, 33, 35 e 57).
Ci sono due gruppi principali di presentazione clinica di HPV: a) lesioni benigne e b) lesioni premaligne o maligne. Le lesioni orali benigne includono il papilloma orale, la verruca vulgaris (verruca comune), il condiloma acuminato orale e l’iperplasia epiteliale focale (malattia di Heck). Le lesioni premaligne e maligne sono rappresentate principalmente da leucoplachia e carcinoma a cellule squamose associate ai genotipi 16 e 18. La trasmissione dell’HPV avviene attraverso pratiche sessuali oro-genitali.
Esistono diverse tecniche per diagnosticare l’HPV, tra le quali possiamo annoverare la citologia convenzionale, la citologia a base liquida, l’istologia, la colposcopia e le tecniche di biologia molecolare come l’ibridazione in situ e la reazione a catena della polimerasi (PCR).15,16 Nel caso clinico qui presentato si è deciso di intraprendere la tipizzazione genica del virus con PCR, questa procedura ha rivelato la presenza di un genotipo 58. Questo dato non è stato documentato nella classificazione riportata in letteratura.
Il trattamento è personalizzato per ogni singolo caso. Si possono utilizzare tecniche distruttive, come la crioterapia o l’elettrochirurgia, l’uso di immunemodulatori (imiquimod al 5%), o l’uso di un antimetabolita per interferire con l’RNA (acido ribo-nucleico) e il DNA, o attraverso l’inibizione della timidilato sintetasi (5-fluoracil).17,18 Nel presente caso si è deciso di utilizzare la chirurgia con bisturi freddo in base alla sede di comparsa della lesione, per avvalersi della possibilità di non lasciare sequele.
CONCLUSIONE
Nella mucosa orale esposta a microtraumi, i microrganismi e i fattori chimici e fisici possono agire sinergicamente con l’HPV per propiziare lo sviluppo di lesioni benigne o del carcinoma.
HPV gioca un ruolo importante nello sviluppo del carcinoma a cellule squamose nel tratto anale e genitale così come nell’epidermodisplasia verruciforme e nella laringe.
Nelle lesioni benigne, i genotipi 33 e 32 sono i più frequenti. Tuttavia, nel nostro studio, il rapporto della procedura di biologia molecolare ha indicato la presenza del genotipo 58.
Nella letteratura mondiale il genotipo 58 non è stato riportato in questo tipo di lesioni che clinicamente sembrano avere un comportamento benigno.
Per affrontare con successo questa condizione, la diagnosi e il trattamento interdisciplinare tra dentisti, oncologi e ginecologi adeguatamente formati nello studio di queste lesioni in prospettiva colposcopica è della massima importanza.
Il trattamento eseguito attraverso un intervento chirurgico con bisturi freddo, con l’obiettivo di lasciare i bordi liberi da lesioni è una soluzione adeguata per sradicare questo tipo di lesioni e non causare sequele, soprattutto nei tumori che sembrano essere clinicamente benigni, ma che secondo il loro gene-tipo, subiranno un comportamento maligno a medio e lungo termine.
Consideriamo il presente case report interessante poiché ci sono pochi rapporti relativi a questa condizione nella bibliografia scientifica messicana.