Punto triplo gas-liquido-solidoModifica
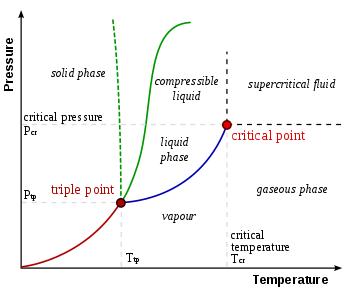
La singola combinazione di pressione e temperatura alla quale l’acqua liquida, il ghiaccio solido e il vapore acqueo possono coesistere in un equilibrio stabile si verifica a circa 273,1575 K (0,0075 °C; 32,0135 °F) e una pressione parziale del vapore di 611,657 pascal (6,11657 mbar; 0,00603659 atm). A quel punto, è possibile cambiare tutta la sostanza in ghiaccio, acqua o vapore facendo cambiamenti arbitrariamente piccoli nella pressione e nella temperatura. Anche se la pressione totale di un sistema è ben al di sopra del punto triplo dell’acqua, a condizione che la pressione parziale del vapore acqueo sia 611,657 pascal, allora il sistema può ancora essere portato al punto triplo dell’acqua. A rigore, le superfici che separano le diverse fasi dovrebbero anche essere perfettamente piane, per annullare gli effetti della tensione superficiale.
Il punto triplo gas-liquido-solido dell’acqua corrisponde alla pressione minima alla quale l’acqua liquida può esistere. A pressioni inferiori al punto triplo (come nello spazio esterno), il ghiaccio solido riscaldato a pressione costante viene convertito direttamente in vapore acqueo in un processo noto come sublimazione. Al di sopra del punto triplo, il ghiaccio solido riscaldato a pressione costante prima si scioglie per formare acqua liquida, e poi evapora o bolle per formare vapore a una temperatura più alta.
Per la maggior parte delle sostanze il punto triplo gas-liquido-solido è anche la temperatura minima alla quale il liquido può esistere. Per l’acqua, tuttavia, questo non è vero perché il punto di fusione del ghiaccio ordinario diminuisce in funzione della pressione, come mostrato dalla linea verde tratteggiata nel diagramma di fase. A temperature appena sotto il punto triplo, la compressione a temperatura costante trasforma il vapore acqueo prima in solido e poi in liquido (il ghiaccio d’acqua ha una densità inferiore a quella dell’acqua liquida, quindi l’aumento della pressione porta a una liquefazione).
Il punto triplo di pressione dell’acqua fu usato durante la missione Mariner 9 su Marte come punto di riferimento per definire il “livello del mare”. Missioni più recenti usano misure di altimetria laser e di gravità invece della pressione per definire l’elevazione su Marte.

Fasi ad alta pressioneModifica
Alle alte pressioni, l’acqua ha un diagramma di fase complesso con 15 fasi note di ghiaccio e diversi punti tripli, di cui 10 le cui coordinate sono mostrate nel diagramma. Per esempio, il punto triplo a 251 K (-22 °C) e 210 MPa (2070 atm) corrisponde alle condizioni di coesistenza di ghiaccio Ih (ghiaccio ordinario), ghiaccio III e acqua liquida, tutti in equilibrio. Ci sono anche punti tripli per la coesistenza di tre fasi solide, per esempio ghiaccio II, ghiaccio V e ghiaccio VI a 218 K (-55 °C) e 620 MPa (6120 atm).
Per quelle forme di ghiaccio ad alta pressione che possono esistere in equilibrio con il liquido, il diagramma mostra che i punti di fusione aumentano con la pressione. A temperature superiori a 273 K (0 °C), aumentando la pressione sul vapore acqueo si ottiene prima acqua liquida e poi una forma di ghiaccio ad alta pressione. Nell’intervallo 251-273 K, si forma prima il ghiaccio I, seguito dall’acqua liquida e poi il ghiaccio III o il ghiaccio V, seguito da altre forme ad alta pressione ancora più dense.

| Fasi in equilibrio stabile | Pressione | Temperatura |
|---|---|---|
| acqua liquida, ghiaccio Ih, e vapore acqueo | 611.657 Pa | 273,16 K (0,01 °C) |
| acqua liquida, ghiaccio Ih e ghiaccio III | 209,9 MPa | 251 K (-22 °C) |
| acqua liquida, ghiaccio III e ghiaccio V | 350.1 MPa | -17.0 °C |
| acqua liquida, ghiaccio V e ghiaccio VI | 632.4 MPa | 0.16 °C |
| Ghiaccio Ih, ghiaccio II, e ghiaccio III | 213 MPa | -35 °C |
| Ghiaccio II, ghiaccio III, e ghiaccio V | 344 MPa | -24 °C |
| Ghiaccio II, ghiaccio V, e ghiaccio VI | 626 MPa | -70 °C |