Che cos’è il protoattinio
Il protoattinio è un metallo altamente radioattivo appartenente alla famiglia degli attinidi e indicato dal simbolo chimico Pa. Ha 27 isotopi con numeri di massa che vanno da 212 a 238 di cui il protoattinio-231 è il più stabile con un’emivita di 3.276 x 104 anni. Dopo di che, forma l’attinio-277 attraverso il decadimento alfa.

Simbolo del protoattinio
Storia
Origine del suo nome: Il suo nome deriva dalla parola greca ‘protos’, che significa primo, aggiunto come prefisso all’elemento attinio.
Chi ha scoperto il protoattinio: Kasimir Fajans e Otto Gohring furono gli scopritori dell’elemento.
Quando e come fu scoperto
Nel 1900, William Crookes isolò un metallo radioattivo non identificato dall’uranio. Tuttavia, fu solo nel 1913 quando Fajans e Gohring mostrarono che il nuovo elemento subì il decadimento beta e confermarono che rientrava nella sequenza degli elementi attraverso il decadimento dell’uranio. Fu identificato come l’isotopo protoattinio-234 con un tempo di dimezzamento di 6 ore e 42 minuti.
Nel 1918, Lise Meitner al Kaiser Wilhelm Institute di Berlino estrasse un altro isotopo protoattinio-231 dalla pechblenda del minerale di uranio.

Protactinium
Identificazione del protoattinio |
|||
|
Numero atomico |
91 | ||
|
Numero CAS |
7440-13-3 |
||
|
Posizione nella tavola periodica |
Gruppo |
Periodo |
Block |
|
Actinidi |
7 |
f |
|
Posizione del protoattinio nella tavola periodica
Proprietà e caratteristiche del protoattinio
Proprietà generali Proprietà |
||
| Massa atomica relativa | 231.036 | |
| Massa atomica | 231.036 unità di massa atomica | |
Proprietà fisiche |
||
| Colore/aspetto | Argento | |
| Lucentezza | Metallico | |
| Punto di fusione/punto di congelamento | 1572°C (2862°F) | |
| Punto di ebollizione punto | 4000°C (7232°F) | |
| Densità | 15.4 g/cm3 | |
| Stato a temperatura ambiente standard (solido/liquido/gas) | Solido | |
| Durezza (Brinell, Mohs, Vickers) | Sconosciuta | |
| Conducibilità termica | 47 W m-1K-1 | |
| Conducibilità elettrica | 5.6 x 106 Sm-1 | |
Proprietà chimiche |
||
| Stati di ossidazione | 5, 4 | |
Dati atomici del protoattinio (elemento 91)
| Configurazione degli elettroni (configurazione dei gas nobili) | 5f26d17s2 | ||||||
| Struttura del cristallo | Face-centrato cubico (fcc) | ||||||
| Struttura atomica | |||||||
| – Numero di elettroni | 91 | ||||||
| – Numero di neutroni | 140 | ||||||
| – Numero di Protoni | 91 | ||||||
| Livelli di energia | |||||||
| – Primo livello energetico | 2 | ||||||
| – Secondo livello energetico | 8 | ||||||
| – Terzo livello energetico | 18 | ||||||
| – Quarto livello energetico | 32 | ||||||
| – Quinto livello energetico | 20 | ||||||
| – Sesto livello energetico | 9 | ||||||
| – Settimo livello energetico | 2 | ||||||
| Raggio dell’atomo | |||||||
| – Raggio atomico | 2.43 Å | ||||||
| – Raggio covalente | 1.84 Å | ||||||
| Elettronegatività | 1.5 | ||||||
| Energia di ionizzazione
(kJmol-1) |
1° | 2° | 3° | 4° | 5° | 6° | 7° |
| 568.3 | – | – | – | – | – | – | |
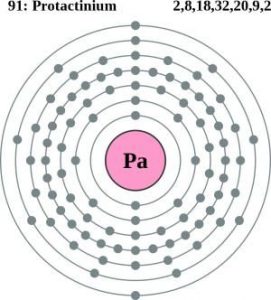
Struttura atomica del protoattinio (Modello Bohr)
Usi del protoattinio
Non ci sono applicazioni pratiche dell’elemento al di fuori della ricerca scientifica di base.
Pericoli del protoattinio
Anche se la natura radioattiva dell’elemento lo rende altamente tossico, la sua scarsita’ in natura non pone alcuna seria minaccia.
Fatti interessanti
- Nel 1961, 125 g di Pa puro furono prodotti alla Great Britain Atomic Energy Authority processando 55.000 kg di minerale che portò ad una spesa di circa 500.000 dollari.
Costo del protoattinio
Il prezzo del metallo può variare tra 250 e 300 dollari al grammo.
- http://www.rsc.org/periodic-table/element/91/protactinium
- https://education.jlab.org/itselemental/ele091.html
- https://www.chemicool.com/elements/protactinium.html
- https://education.jlab.org/itselemental/iso091.html
- https://hobart.k12.in.us/ksms/PeriodicTable/protactinium.htm
- http://www.ivyroses.com/Chemistry/Chemical-Elements_List-ByNameofElement.php
- https://www.nuclear-power.net/protactinium-affinity-electronegativity-ionization/
- http://periodictable.com/Elements/091/data.html
- http://www.chemicalelements.com/elements/pa.html
- https://www.raci.org.au/document/item/470