Por que é que as reacções ocorrem a ritmos diferentes? Porque é que algumas acontecem rapidamente, e outras procedem muito lentamente? Porque é que a mesma reacção pode ter lugar a ritmos diferentes em condições diferentes? Há vários factores que influenciam as taxas de reacção, mas este artigo centra-se na barreira de activação.
Uma barreira de activação é uma espécie de obstáculo energético que uma reacção deve ultrapassar. Algumas reacções têm obstáculos mais altos e outras têm obstáculos mais baixos. É mais fácil ultrapassar obstáculos inferiores, pelo que as reacções com barreiras de activação baixas podem avançar mais rapidamente do que as com barreiras de activação mais altas:
- Uma barreira de activação baixa permite que uma reacção aconteça rapidamente.
- Uma barreira de activação alta faz com que uma reacção avance mais lentamente.
Uma reacção pode ser exergónica em geral, mas ainda tem uma barreira de activação no início. Mesmo que o sistema diminua de energia no final da reacção, geralmente experimenta um aumento inicial de energia.
-
p>P>P>Se uma reacção der energia em geral, a energia deve ser adicionada inicialmente para iniciar a reacção.
Esta situação é semelhante a investir num negócio. Um negócio requer geralmente um investimento financeiro para começar. Se o negócio for bem sucedido, acabará por fazer produtos e pagar dinheiro aos investidores. Se o negócio não for capaz de fazer o seu investimento inicial, pode falhar.
Reacções requerem um investimento inicial de energia. Esta energia pode vir das moléculas circundantes ou do ambiente em geral. Se a reacção for bem sucedida, procederá à fabricação de produtos e emitirá energia de volta ao seu ambiente.
- Custa sempre uma molécula de energia a entrar numa reacção; “toma emprestada” essa energia do seu ambiente.
- Que o investimento inicial de energia pode ser “pago de volta” à medida que a reacção avança.
Todas as reacções devem ultrapassar as barreiras de activação para que possam ocorrer. A barreira de activação é a soma da energia que tem de ser gasta para que a reacção ocorra. Uma barreira de activação é frequentemente retratada como uma colina que os reagentes têm de ultrapassar durante a reacção. Uma vez lá, pode deslizar pelo outro lado da colina para se tornar produto. No topo da colina, a molécula existe no que se chama o “estado de transição”. No estado de transição, a estrutura está algures entre a sua forma original e a estrutura dos produtos.
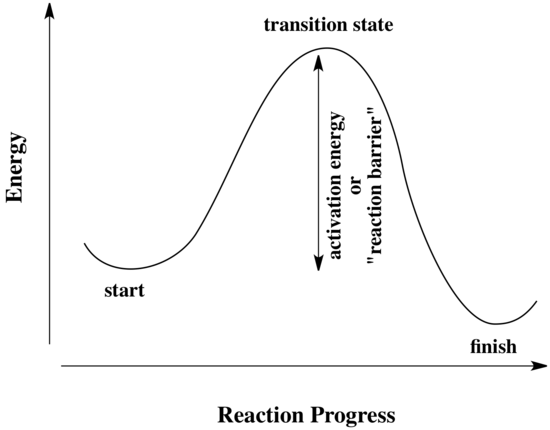
O tipo de diagrama mostrado acima é por vezes chamado de “diagrama de progresso da reacção”. Mostra as mudanças de energia no sistema à medida que uma reacção avança. Uma ou mais barreiras de activação podem existir ao longo das vias de reacção, devido a várias etapas elementares da reacção.
Para compreender mais concretamente os termos “progresso da reacção” e “estado de transição”, considere uma reacção real. Suponha que um nucleófilo, tal como um ião acetilide, doa os seus electrões a um carbonilo electrofílico. A π ligação quebra-se e forma-se um ião alcóxido.

“progresso da reacção” refere-se ao grau de progresso da reacção. O estado de transição refere-se especificamente ao ponto mais elevado de energia no caminho entre os reagentes e os produtos. Refere-se à estrutura nesse ponto, e à energia associada a essa estrutura.
No diagrama seguinte, o termo “progresso da reacção” foi substituído por uma ilustração que combina o estado da reacção com o ponto correspondente na curva da energia. A estrutura entre parênteses rectos é o estado de transição, correspondente ao máximo da curva. O símbolo “dupla adaga” indica uma estrutura de estado de transição.
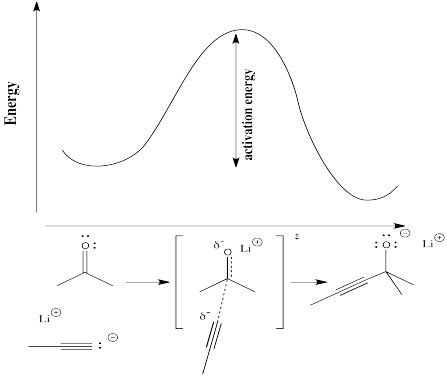
O estado de transição não é uma verdadeira estrutura química. Não obedece necessariamente às regras das estruturas Lewis, porque algumas novas ligações começaram a formar-se e algumas ligações antigas começaram a quebrar-se; as ligações parciais não têm lugar numa estrutura Lewis.
Fisicamente, a estrutura do estado de transição não pode ser isolada. Porque se situa no topo de uma curva energética, o estado de transição tende a converter-se noutra coisa. Uma mudança em qualquer direcção irá baixar a sua energia. A tendência é para avançar para a energia mais baixa, se possível. Assim que o estado de transição se formar, ou desliza de volta para os materiais de partida originais ou desliza para a frente para os produtos finais.
-
O estado de transição é inerentemente uma estrutura de alta energia, instável e com uma vida útil muito curta. Assim que é formada, desaparece.
Contribuidores e Atribuições
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)