Sigma e Pi Bonds
O modelo de hibridação ajuda a explicar moléculas com ligações duplas ou triplas (ver figura abaixo). Eteno \(esquerda( \ce{C_2H_4} {C_2H_4}direita)} contém uma ligação covalente dupla entre os dois átomos de carbono e ligações simples entre os átomos de carbono e os átomos de hidrogénio. A molécula inteira é planar.
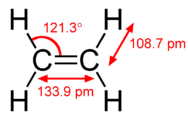
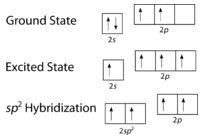
Como se pode ver na figura abaixo, a geometria do domínio dos electrões em torno de cada carbono independentemente é planar trigonal. Isto corresponde à hibridização \(sp^2\). Anteriormente, vimos o carbono sofrer hibridação numa molécula, pelo que a promoção dos electrões é a mesma para o eteno, mas a hibridação ocorre apenas entre o orbital simples e dois dos três orbitais. Assim, gera um conjunto de três híbridos juntamente com um orbital não hibridizado. Cada um contém um electrão e por isso é capaz de formar uma ligação covalente.
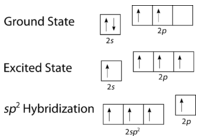
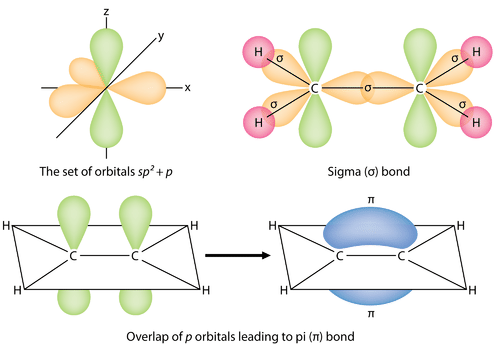
Os três orbitais híbridos {(sp^2}) situam-se num plano, enquanto o orbital não-hibridizado {(2p_z} é orientado perpendicularmente a esse plano. A colagem em C_2H_4 é explicada da seguinte forma. Um dos três híbridos (sp^2) forma uma ligação por sobreposição com o orbital híbrido idêntico no outro átomo de carbono. Os restantes dois orbitais híbridos formam ligações por sobreposição com o orbital de um átomo de hidrogénio. Finalmente, os orbitais \\i(2p_z) em cada átomo de carbono formam outra ligação, sobrepondo-se um ao outro de lado.
É necessário distinguir entre os dois tipos de ligações covalentes numa molécula \i(c_2H_4}). Uma ligação sigma (\\sigma) é uma ligação formada pela sobreposição de orbitais de ponta a ponta, com a densidade de electrões concentrada entre os núcleos dos átomos de ligação. Uma ligação pi (\pi) é uma ligação formada pela sobreposição de orbitais de uma forma lado a lado com a densidade de electrões concentrada acima e abaixo do plano dos núcleos dos átomos de ligação. A figura abaixo mostra os dois tipos de ligação em C_2H_4). Os orbitais híbridos são roxos e o orbital é azul. Formam-se três ligações sigma de cada átomo de carbono para um total de seis ligações sigma no total da molécula. A ligação pi é a “segunda” ligação das ligações duplas entre os átomos de carbono e é mostrada como um lóbulo verde alongado que se estende tanto acima como abaixo do plano da molécula. Este plano contém os seis átomos e todas as ligações sigma.
Numa estrutura convencional de Lewis electron-dot, uma ligação dupla é mostrada como um traço duplo entre os átomos como em {C=C}}. É importante perceber, contudo, que as duas ligações são diferentes: uma é uma ligação sigma, enquanto a outra é uma ligação pi.
Ethyne \(\ce{C_2H_2} {C_2H_2} {A direita)} é uma molécula linear com uma ligação tripla entre os dois átomos de carbono (ver figura abaixo). A hibridação é portanto \(sp\).
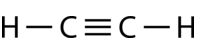
A promoção de um electrão no átomo de carbono ocorre da mesma forma. Contudo, a hibridação envolve agora apenas o orbital e o orbital, deixando os orbitais não hibridizados.
Os orbitais híbridos {(sp\) formam uma ligação sigma entre si, bem como ligações sigma aos átomos de hidrogénio. Tanto os orbitais {(p_y} como os orbitais {(p_z} em cada átomo de carbono formam ligações sigma entre si. Tal como acontece com o eteno, estas sobreposições laterais estão acima e abaixo do plano da molécula. A orientação das duas ligações de pi é que são perpendiculares uma à outra (ver figura abaixo). Uma ligação de pi está acima e abaixo da linha da molécula, como mostrado, enquanto a outra está à frente e atrás da página.
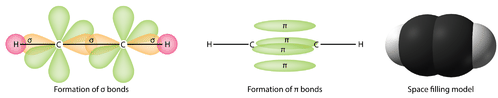
Em geral, ligações únicas entre átomos são sempre ligações sigma. As ligações duplas são compostas por uma ligação sigma e uma ligação pi. As ligações triplas são constituídas por uma ligação sigma e duas ligações pi.