O que aprenderás a fazer: Descrever a estrutura e funções das proteínas
Proteínas são polímeros de aminoácidos. Cada aminoácido contém um carbono central, um hidrogénio, um grupo carboxilo, um grupo amino, e um grupo R variável. O grupo R especifica a que classe de aminoácidos pertence: cadeias laterais hidrofílicas carregadas electricamente, cadeias laterais polares mas não carregadas, cadeias laterais hidrofóbicas não polares, e casos especiais.
Proteínas têm diferentes “camadas” de estrutura: primária, secundária, terciária, quaternária.
Proteínas têm uma variedade de funções nas células. As principais funções incluem actuar como enzimas, receptores, moléculas de transporte, proteínas reguladoras para expressão genética, e assim por diante. As enzimas são catalisadores biológicos que aceleram uma reacção química sem serem permanentemente alteradas. Têm “sítios activos” onde o substrato/reagente se liga, e podem ser activados ou inibidos (inibidores competitivos e/ou não competitivos).
Resultados de aprendizagem
- Identificar as partes componentes das proteínas
- Definir as diferentes camadas da estrutura das proteínas
- Identificar várias funções principais de proteínas
Componentes de Proteínas
Proteínas são uma das moléculas orgânicas mais abundantes nos sistemas vivos e têm a mais diversa gama de funções de todas as macromoléculas. As proteínas podem ser estruturais, reguladoras, contráteis, ou protectoras; podem servir no transporte, armazenamento ou membranas; ou podem ser toxinas ou enzimas. Cada célula de um sistema vivo pode conter milhares de proteínas diferentes, cada uma com uma função única. As suas estruturas, tal como as suas funções, variam muito. São, contudo, todos polímeros de aminoácidos, dispostos numa sequência linear.
Proteínas têm diferentes formas e pesos moleculares; algumas proteínas têm forma globular enquanto outras são de natureza fibrosa. Por exemplo, a hemoglobina é uma proteína globular, mas o colagénio, encontrado na nossa pele, é uma proteína fibrosa. A forma da proteína é fundamental para a sua função. Alterações na temperatura, pH, e exposição a químicos podem levar a alterações permanentes na forma da proteína, levando a uma perda de função ou desnaturação (a ser discutido mais detalhadamente mais tarde). Todas as proteínas são constituídas por diferentes arranjos dos mesmos 20 tipos de aminoácidos.
Aminoácidos são os monómeros que compõem as proteínas. Cada aminoácido tem a mesma estrutura fundamental, que consiste num átomo central de carbono ligado a um grupo amino (-NH2), um grupo carboxil (-COOH), e um átomo de hidrogénio. Cada aminoácido tem também outro átomo variável ou grupo de átomos ligados ao átomo central de carbono conhecido como o grupo R. O grupo R é a única diferença de estrutura entre os 20 aminoácidos; caso contrário, os aminoácidos são idênticos.

Figure 1. Os aminoácidos são compostos por um carbono central ligado a um grupo amino (-NH2), um grupo carboxil (-COOH), e um átomo de hidrogénio. A quarta ligação do carbono central varia entre os diferentes aminoácidos, como se vê nestes exemplos de alanina, valina, lisina, e ácido aspártico.
A natureza química do grupo R determina a natureza química do aminoácido dentro da sua proteína (ou seja, se é ácido, básico, polar, ou não-polar).
A sequência e o número de aminoácidos determinam em última análise a forma, tamanho e função de uma proteína. Cada aminoácido é ligado a outro aminoácido por uma ligação covalente, conhecida como ligação peptídea, que é formada por uma reacção de desidratação. O grupo carboxilo de um aminoácido e o grupo aminoácido de um segundo aminoácido combinam-se, libertando uma molécula de água. A ligação resultante é a ligação peptídeo.
Os produtos formados por tal ligação são chamados polipéptidos. Enquanto os termos polipeptídeo e proteína são por vezes utilizados permutavelmente, um polipeptídeo é tecnicamente um polímero de aminoácidos, enquanto o termo proteína é utilizado para um polipeptídeo ou polipeptídeos que se combinaram, têm uma forma distinta, e têm uma função única.
A significância evolutiva do citocromo c
Citocromo c é um componente importante da cadeia de transporte de electrões, uma parte da respiração celular, e encontra-se normalmente na organela celular, a mitocôndria. Esta proteína tem um grupo protético heme, e o íon central do heme fica alternadamente reduzido e oxidado durante a transferência dos electrões. Como o papel desta proteína essencial na produção de energia celular é crucial, ela mudou muito pouco ao longo de milhões de anos. A sequenciação proteica mostrou que existe uma quantidade considerável de homologia da sequência de aminoácidos citocromo c, ou similaridade, entre diferentes espécies – por outras palavras, o parentesco evolutivo pode ser avaliado medindo as semelhanças ou diferenças entre as sequências de ADN ou proteínas de várias espécies.
Os cientistas determinaram que o citocromo c humano contém 104 aminoácidos. Para cada molécula de citocromo c de organismos diferentes que foram sequenciados até à data, 37 destes aminoácidos aparecem na mesma posição em todas as amostras de citocromo c. Isto indica que pode ter havido um antepassado comum. Ao comparar as sequências de proteínas humanas e de chimpanzés, não foi encontrada qualquer diferença na sequência. Quando se compararam as sequências humanas e de macacos rhesus, a única diferença encontrada foi num único aminoácido. Numa outra comparação, a sequenciação humana com levedura mostra uma diferença na 44ª posição.
Estrutura da proteína
Como discutido anteriormente, a forma de uma proteína é crítica para a sua função. Para compreender como a proteína obtém a sua forma ou conformação final, precisamos de compreender os quatro níveis da estrutura da proteína: primária, secundária, terciária, e quaternária (Figura 3).
A sequência única e o número de aminoácidos numa cadeia de polipeptídeos é a sua estrutura primária. A sequência única para cada proteína é, em última análise, determinada pelo gene que codifica a proteína. Qualquer alteração na sequência genética pode levar à adição de um aminoácido diferente à cadeia de polipeptídeos, causando uma mudança na estrutura e função da proteína. Na anemia falciforme, a cadeia da hemoglobina β tem uma única substituição de aminoácidos, causando uma mudança tanto na estrutura como na função da proteína. O mais notável a considerar é que uma molécula de hemoglobina é constituída por duas cadeias alfa e duas cadeias beta que consistem cada uma em cerca de 150 aminoácidos. A molécula, portanto, tem cerca de 600 aminoácidos. A diferença estrutural entre uma molécula de hemoglobina normal e uma molécula de foice – que diminui dramaticamente a esperança de vida – é um único aminoácido do 600.
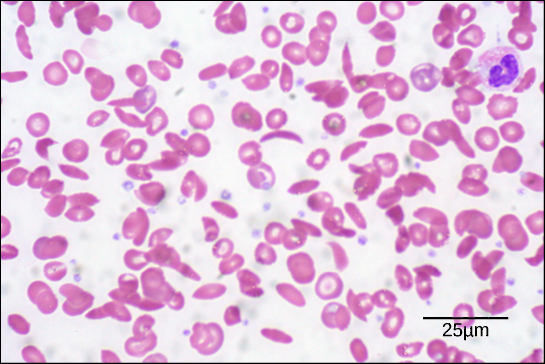
Figure 2. Neste esfregaço de sangue, visualizado com uma ampliação de 535x usando microscopia de campo brilhante, as células falciformes têm a forma de lua crescente, enquanto que as células normais têm a forma de disco. (crédito: modificação do trabalho por Ed Uthman; dados em forma de barra de escala de Matt Russell)
Por causa desta alteração de um aminoácido na cadeia, os glóbulos vermelhos normalmente biconcavos, ou em forma de disco, assumem uma forma em crescente ou “foice”, que obstrui as artérias. Isto pode levar a uma miríade de graves problemas de saúde, tais como falta de ar, tonturas, dores de cabeça e dores abdominais para aqueles que têm esta doença.
Padrões de dobra resultantes das interacções entre as porções de aminoácidos não-R do grupo dão origem à estrutura secundária da proteína. As mais comuns são as estruturas de folhas alfa (α)-helix e beta (β)-pleadas. Ambas as estruturas são mantidas em forma por ligações de hidrogénio. Na hélice alfa, as ligações formam-se entre cada quarto aminoácido e causam uma torção na cadeia de aminoácidos.
Na folha plissada em β, as “pregas” são formadas pela ligação de hidrogénio entre átomos na espinha dorsal da cadeia de polipeptídeos. Os grupos R são ligados aos carbonos, e estendem-se acima e abaixo das dobras da dobra. Os segmentos pregueados alinham-se paralelamente uns aos outros, e as ligações de hidrogénio formam-se entre os mesmos pares de átomos em cada um dos aminoácidos alinhados. As estruturas de folhas plissadas α-helix e β são encontradas em muitas proteínas globulares e fibrosas.
A estrutura tridimensional única de um polipeptídio é conhecida como a sua estrutura terciária. Esta estrutura é causada por interacções químicas entre vários aminoácidos e regiões do polipeptídeo. Principalmente, as interacções entre grupos R criam a complexa estrutura tridimensional terciária de uma proteína. Pode haver ligações iónicas formadas entre grupos R em diferentes aminoácidos, ou ligações de hidrogénio para além das envolvidas na estrutura secundária. Quando a proteína se dobra, os grupos R hidrofóbicos de aminoácidos não polares encontram-se no interior da proteína, enquanto que os grupos R hidrofílicos se encontram no exterior. Os primeiros tipos de interacções são também conhecidos como interacções hidrofóbicas.
Na natureza, algumas proteínas são formadas a partir de vários polipéptidos, também conhecidos como subunidades, e a interacção destas subunidades forma a estrutura quaternária. As fracas interacções entre as subunidades ajudam a estabilizar a estrutura global. Por exemplo, a hemoglobina é uma combinação de quatro subunidades de polipeptídeos.
Cada proteína tem a sua própria sequência e forma únicas mantidas juntas por interacções químicas. Se a proteína estiver sujeita a alterações na temperatura, pH, ou exposição a químicos, a estrutura da proteína pode mudar, perdendo a sua forma no que é conhecido como desnaturação, tal como discutido anteriormente. A desnaturação é frequentemente reversível porque a estrutura primária é preservada se o agente desnaturante for removido, permitindo que a proteína retome a sua função. Por vezes, a desnaturação é irreversível, levando a uma perda de função. Um exemplo de desnaturação da proteína pode ser visto quando um ovo é frito ou cozido. A proteína da albumina na clara de ovo líquida é desnaturada quando colocada numa panela quente, passando de uma substância clara para uma substância branca opaca. Nem todas as proteínas são desnaturadas a altas temperaturas; por exemplo, as bactérias que sobrevivem em fontes quentes têm proteínas que são adaptadas para funcionar a essas temperaturas.
Os quatro níveis da estrutura proteica (primária, secundária, terciária e quaternária) são ilustrados na Figura 3.
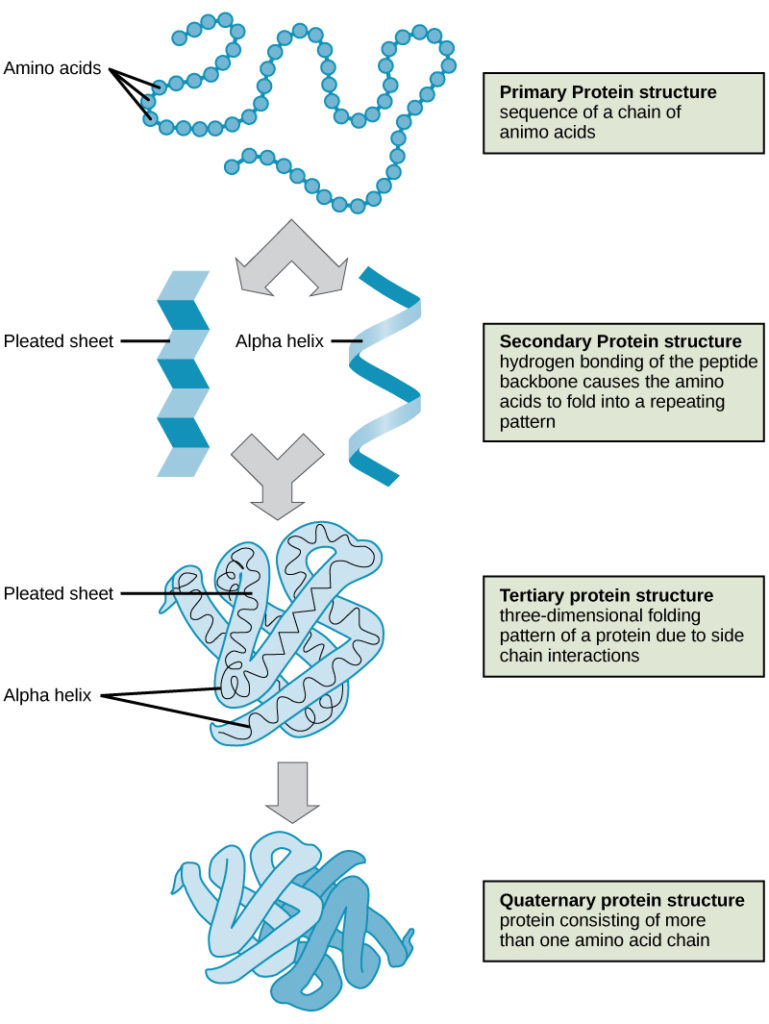
Figure 3. Os quatro níveis da estrutura proteica podem ser observados nestas ilustrações. (crédito: modificação do trabalho do National Human Genome Research Institute)
Função das Proteínas
Os principais tipos e funções das proteínas estão listados na Tabela 1.
| Tabela 1. Tipos de Proteína e Funções | ||
|---|---|---|
| Enzimas Digestivas | Amilase, lipase, pepsin, trypsin | Ajuda na digestão de alimentos por catabolização de nutrientes em unidades monoméricas |
| Transporte | Hemoglobina, albumina | Carregar substâncias no sangue ou linfa por todo o corpo |
| Structural | Actina, tubulina, queratina | Construir estruturas diferentes, como o citoesqueleto |
| Hormonas | Insulina, thyroxine | |
| Actin, myosin | Contracção muscular de efeito | |
| Armazenamento | Proteínas de armazenamento de legumes, clara de ovo (albumina) | |
Duas proteínas especiais e comuns são enzimas e hormonas. As enzimas, que são produzidas por células vivas, são catalisadores em reacções bioquímicas (como a digestão) e são geralmente proteínas complexas ou conjugadas. Cada enzima é específica para o substrato (um reagente que se liga a uma enzima) sobre o qual actua. A enzima pode ajudar na decomposição, rearranjo, ou reacções de síntese. As enzimas que decompõem os seus substratos são chamadas enzimas catabólicas, as enzimas que constroem moléculas mais complexas dos seus substratos são chamadas enzimas anabólicas, e as enzimas que afectam a taxa de reacção são chamadas enzimas catalíticas. É de notar que todas as enzimas aumentam a taxa de reacção e, portanto, são consideradas como catalisadores orgânicos. Um exemplo de uma enzima é a amilase salivar, que hidrolisa o seu substrato amilose, um componente do amido.
Hormonas são moléculas de sinalização química, geralmente pequenas proteínas ou esteróides, secretadas por células endócrinas que actuam para controlar ou regular processos fisiológicos específicos, incluindo crescimento, desenvolvimento, metabolismo, e reprodução. Por exemplo, a insulina é uma hormona proteica que ajuda a regular o nível de glucose no sangue.
Proteínas têm diferentes formas e pesos moleculares; algumas proteínas têm forma globular enquanto outras são de natureza fibrosa. Por exemplo, a hemoglobina é uma proteína globular, mas o colagénio, encontrado na nossa pele, é uma proteína fibrosa. A forma da proteína é fundamental para a sua função, e esta forma é mantida por muitos tipos diferentes de ligações químicas. Alterações na temperatura, pH, e exposição a químicos podem levar a alterações permanentes na forma da proteína, levando à perda da função, conhecida como desnaturação. Todas as proteínas são constituídas por diferentes arranjos dos mesmos 20 tipos de aminoácidos.
Em resumo: Função das Proteínas
Proteínas são uma classe de macromoléculas que desempenham uma gama diversificada de funções para a célula. Ajudam no metabolismo, fornecendo apoio estrutural e actuando como enzimas, portadores, ou hormonas. Os blocos de construção das proteínas (monómeros) são aminoácidos. Cada aminoácido tem um carbono central que está ligado a um grupo amino, um grupo carboxil, um átomo de hidrogénio, e um grupo R ou cadeia lateral. Existem 20 aminoácidos que ocorrem normalmente, cada um dos quais difere no grupo R. Cada aminoácido está ligado aos seus vizinhos por uma ligação de peptídeo. Uma longa cadeia de aminoácidos é conhecida como polipéptido.
Proteínas são organizadas em quatro níveis: primário, secundário, terciário, e (opcional) quaternário. A estrutura primária é a sequência única de aminoácidos. A dobragem local do polipeptídeo para formar estruturas como a hélice α e a folha plissada β constitui a estrutura secundária. A estrutura tridimensional global é a estrutura terciária. Quando dois ou mais polipeptídeos se combinam para formar a estrutura proteica completa, a configuração é conhecida como a estrutura quaternária de uma proteína. A forma e função da proteína estão intrinsecamente ligadas; qualquer alteração na forma causada por alterações na temperatura ou pH pode levar à desnaturação da proteína e a uma perda na função.
Check Your Understanding
Responder à(s) pergunta(s) abaixo para ver até que ponto compreende os tópicos abordados na secção anterior. Este pequeno questionário não conta para a sua nota na aula, e pode repeti-lo um número ilimitado de vezes.
Utilize este questionário para verificar a sua compreensão e decidir se (1) estuda melhor a secção anterior ou (2) passa para a secção seguinte.