Então, como é que os oceanos se formaram em primeiro lugar? Lembrar da secção 3.1 que a Terra foi formada através da acumulação de vários materiais, e que se seguiu um período de derretimento e intensa actividade vulcânica. Os materiais que acresceram na Terra primitiva continham os componentes que acabariam por se tornar os nossos oceanos e atmosfera. Sob as altas pressões encontradas no interior da Terra, os gases permanecem dissolvidos no magma. À medida que estes magmas sobem à superfície através da actividade vulcânica, a pressão é reduzida e os gases são libertados através de um processo chamado outgassing. A actividade vulcânica liberta muitos gases diferentes, incluindo vapor de água, dióxido de carbono (CO2), dióxido de enxofre (SO2), monóxido de carbono (CO), sulfureto de hidrogénio (H2S), gás hidrogénio, nitrogénio, e metano (CH4). Os gases mais leves como o hidrogénio e o hélio dissiparam-se no espaço, mas os gases mais pesados permaneceram e formaram a atmosfera inicial da Terra.
Quando a Terra arrefeceu, o vapor de água na atmosfera condensou e caiu como chuva. Há cerca de 4 mil milhões de anos, as primeiras acumulações permanentes de água estavam presentes na Terra, formando os oceanos e outros corpos de água. A água move-se entre estes diferentes reservatórios ao longo do ciclo hidrológico. A água é evaporada dos oceanos, lagos, riachos, a superfície da terra e plantas (transpiração) pela energia solar (Figura 5.2.1). É movida através da atmosfera pelos ventos e condensa para formar nuvens de gotas de água ou cristais de gelo. Desce como chuva ou neve e depois corre através de riachos e rios, para lagos, e eventualmente de volta aos oceanos. A água na superfície e nos riachos e lagos infiltra-se no solo para se tornar água subterrânea. A água subterrânea move-se lentamente através das rochas e materiais de superfície; alguns regressam a outros riachos e lagos, e alguns regressam directamente aos oceanos.
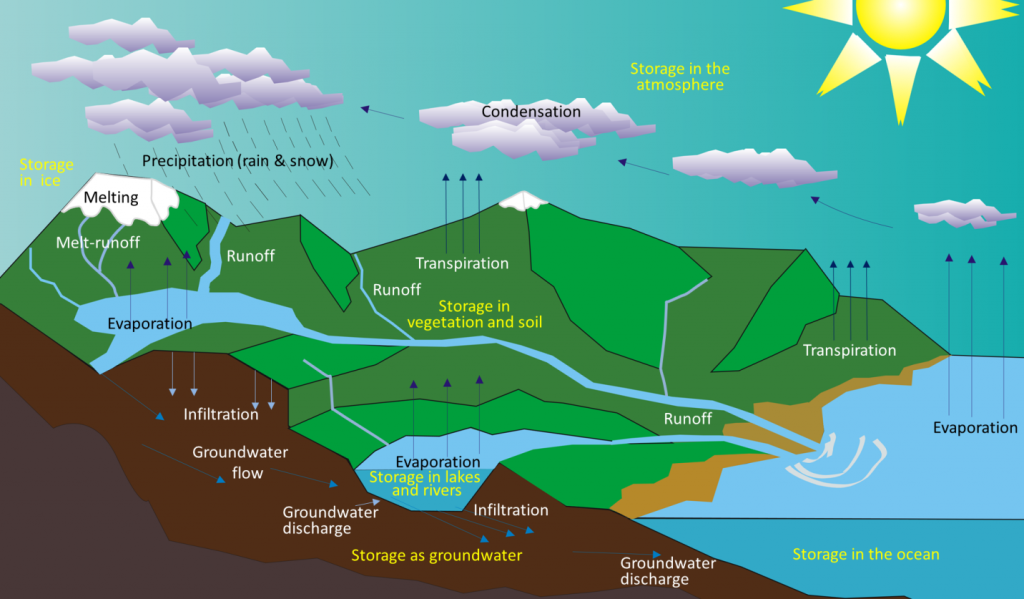
A água é armazenada em vários reservatórios à medida que se desloca através deste ciclo. O maior, de longe, é o dos oceanos, representando 97% do volume (Figura 5.2.2). É claro, que a água é salgada. Os restantes 3% são de água doce. Dois terços da nossa água doce são armazenados no solo e um terço é armazenado em gelo. A água doce restante – cerca de 0,03% do total – é armazenada em lagos, riachos, vegetação e atmosfera.
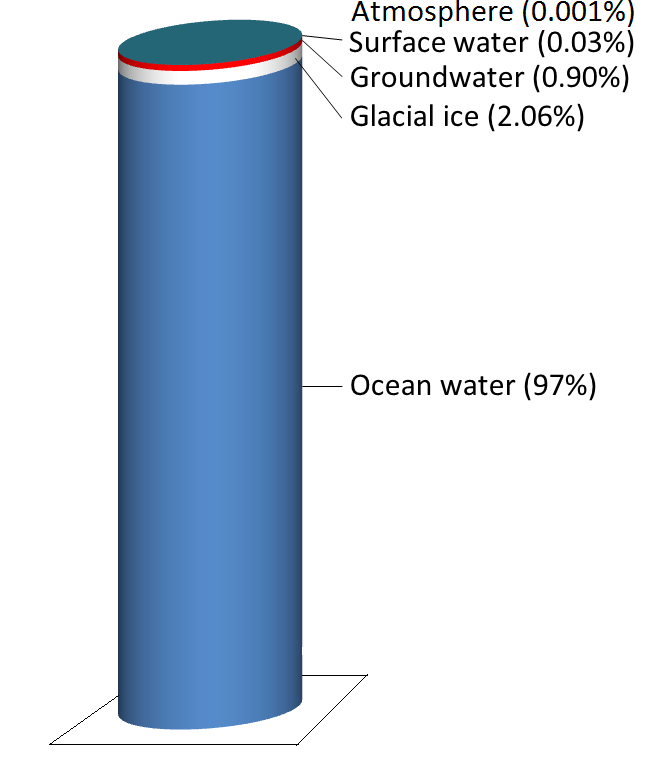
Para colocar isso em perspectiva, vamos pensar em colocar toda a água da Terra num jarro de 1 L. Começamos por encher quase o jarro com 970 ml de água e 34 g de sal. Depois adicionamos um cubo de gelo de tamanho regular (~20 mL) (representando gelo glacial) e duas colheres de chá (~10 mL) de água subterrânea. Toda a água que vemos à nossa volta em lagos e riachos e no céu pode ser representada pela adição de mais três gotas de um conta-gotas.
P>Embora a proporção de água da Terra que está na atmosfera seja minúscula, o volume real é enorme. Em qualquer momento, há o equivalente a aproximadamente 13.000 km3 de água no ar sob a forma de vapor de água e gotículas de água nas nuvens. A água evapora-se dos oceanos, vegetação e lagos a uma taxa de 1.580 km3 por dia, e caem quase exactamente o mesmo volume que a chuva e a neve todos os dias, tanto sobre os oceanos como sobre a terra. A precipitação que cai em terra regressa ao oceano sob a forma de fluxo de riachos (117 km3/dia) e fluxo de águas subterrâneas (6 km3/dia).
Como é que os oceanos ficaram salgados?
Agotamento foi responsável pela formação do oceano, mas como é que a água do oceano ficou salgada? A maior parte dos sais e elementos dissolvidos no oceano foram provavelmente desgaseificados juntamente com o vapor de água, por isso o oceano sempre foi provavelmente tão salgado como é agora. Mas sabemos que a precipitação e outros processos provocam rochas na superfície da Terra, e o escoamento superficial transporta substâncias dissolvidas para o oceano, contribuindo para a sua salinidade. No entanto, apesar desta entrada constante, a composição do sal do oceano permanece essencialmente a mesma. Portanto, a taxa de entrada de novo material deve ser equilibrada pela taxa de remoção; por outras palavras, os oceanos estão num estado estável no que diz respeito à salinidade.
Existem múltiplas vias através das quais os iões dissolvidos entram no oceano; escoamento de cursos de água e rios, actividade vulcânica, respiradouros hidrotermais (ver secção 4.11), dissolução ou decomposição de substâncias no oceano, e entrada de águas subterrâneas. Os iões são removidos da água do mar à medida que são incorporados por organismos vivos (por exemplo, na produção de conchas) ou sedimentos, spray marinho, percolação da água na crosta, ou quando a água do mar fica isolada do oceano e evapora.
A relação entre a entrada e a remoção de um ião pode ser examinada através do conceito de tempo de residência, que é o tempo médio que um único átomo de um elemento permanece no oceano antes de ser removido. O tempo de residência é calculado como:
![]()
Há uma grande variação no tempo de residência para diferentes substâncias (Tabela 5.2.1). Em geral, as substâncias que são prontamente utilizadas em processos biológicos têm tempos de residência curtos, uma vez que são consumidas à medida que se tornam disponíveis. As substâncias com tempos de residência mais longos são menos reactivas, e podem fazer parte de ciclos geológicos de longa escala.
Tabela 5.2.1 Tempos de residência para alguns constituintes da água do mar
| Constituent | Tempo de residência (anos) |
|---|---|
| Chloride (Cl-) | 100,000,000 |
| 1.000,000 | |
| Água | 4100 |
| 200 |
Então e os lagos? Estão sujeitos ao escoamento superficial e à entrada do rio, então porque não são salgados como os oceanos? Uma razão é que em comparação com os oceanos, lagos e lagoas são fenómenos relativamente temporários, pelo que não duram o tempo suficiente para acumular os mesmos níveis de iões que os oceanos. Além disso, os lagos têm frequentemente rios que fluem tanto para dentro como para fora deles, pelo que muitos iões são removidos através do fluxo, acabando por encontrar o seu caminho para os oceanos. Os oceanos apenas recebem a entrada dos rios; não há rios que fluem para fora do oceano para remover estes materiais, pelo que se encontram em maior abundância na água do mar. É de notar que existem alguns lagos que contêm água cujo teor em sal pode rivalizar ou exceder o do oceano; estes lagos normalmente não têm vazão fluvial. O Grande Lago de Sal no oeste dos Estados Unidos é um exemplo.
*”Geologia Física” por Steven Earle utilizado sob uma licença internacional CC-BY 4.0. Descarregar este livro gratuitamente em http://open.bccampus.ca
o processo pelo qual corpos celestes sólidos são adicionados aos corpos existentes durante as colisões (3.1)
água que se encontra abaixo da superfície do solo (5.2)
onde um sistema não mostra nenhuma alteração líquida, uma vez que a entrada é igual à saída (5.2)
o tempo médio que um elemento permanecerá no oceano antes de ser removido (5.2)