Contenuti
- 1 Introduzione
- 2 Cristallizzazione e diffrazione dei raggi X
- 3 Struttura
- 4 Funzione
- 5 Malattia
- 6 Strutture 3D della miosina
.
Introduzione
La miosina è una delle tre principali classi di proteine motore molecolari: Miosina, dineina e chinesina. Essendo la più abbondante di queste proteine, la miosina svolge un ruolo strutturale ed enzimatico nella contrazione muscolare e nella motilità intracellulare. La miosina è stata scoperta per la prima volta nel muscolo nel XIX secolo. La miosina è una superfamiglia di proteine che legano l’actina, idrolizzano l’ATP e trasmettono la forza. Quindi la maggior parte si trova nelle cellule muscolari. Composta da domini di testa, collo e coda. Il dominio di testa lega l’actina e si muove lungo di essa. Il collo è un linker e lega le catene leggere che hanno una funzione di regolazione. La coda interagisce con le molecole di carico (CBD)m. Ci sono 18 classi di miosina.
Le miosine non convenzionali non formano filamenti.
- La miosina II (MII) è la più studiata. Guida la motilità ad alta velocità come la contrazione muscolare. MII contiene 2 catene pesanti (HC) che costituiscono il dominio di testa o motore (MD) e il dominio di coda e 4 catene leggere (LC) che sono denominate LC essenziali (ELC) e LC regolatorie (RLC).
- La miosina III (MIII) contiene un dominio chinasico C-terminale collegato al dominio motore.
- La miosina V (MV) lavora con i motori basati sui microtubuli come la chinesina.
- La miosina VI (MVI) si muove verso l’estremità inferiore del filamento di actina.
- La miosina VII (MVII) ha una coda corta e può agire nel movimento delle membrane intracellulari.
- La miosina X (MX) è un effettore a valle della PI(3)K durante la fagocitosi.
- La miosina XI (MXI) collega la membrana nucleare al citoscheletro.
Vedi anche Miosina (ebraico).
Cristallizzazione e diffrazione a raggi X
La miosina si trova in abbondanza, quindi può essere preparata in quantità di grammi. Per quasi 30 anni la testa della miosina è stata resistente alla cristallizzazione, ma nel 1993 i ricercatori hanno scoperto un meccanismo per ottenere cristalli di qualità a raggi X. Il processo ha modificato la proteina per metilazione riduttiva. I dati a raggi X sono stati usati per determinare la struttura terziaria della proteina.
Struttura
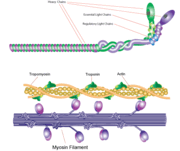
Filamento di miosina
La miosina ha una dimensione molecolare di circa 520 kilodaltoni con un totale di sei subunità. Ha due catene pesanti di 220 kD che costituiscono la maggior parte della struttura complessiva e due coppie di catene leggere che variano in dimensione. La molecola è asimmetrica, avendo una lunga coda e due teste globulari. Ogni catena pesante compone la maggior parte di una delle teste globulari. Il sottoframmento-1 (S1), chiamato anche testa della miosina, consiste di ATP, actina e due siti di legame per le catene leggere. Ogni testa globulare ha una catena pesante e due catene leggere per una dimensione molecolare combinata di circa 130 kD.
La testa della miosina è asimmetrica con una lunghezza di 165 Angstrom e 65 Angstrom di larghezza, con uno spessore totale di circa 40 Angstrom. Circa il 48% dei residui aminoacidici nella testa della miosina sono dominati da eliche α. Al termine carbossilico, una lunga elica α di circa 85 Angstrom si estende in una spirale sinistra. Questa particolare elica forma la regione di legame alla catena leggera del dominio globulare. Il terminale amminico di ogni catena pesante ha un grande dominio globulare che contiene il sito di idrolisi dell’ATP.
Funzione
Le molecole di miosina si aggregano nelle cellule muscolari per formare filamenti spessi. La struttura a bastoncino di questi filamenti spessi agisce come il nucleo dell’unità contrattile del muscolo. L’aggregazione di diverse centinaia di miosine forma una struttura bipolare che si impila in matrici regolari. I muscoli sono costituiti da un’altra proteina chiamata actina. L’actina forma il filamento sottile nelle fibre muscolari. La miosina e l’actina interagiscono attraverso legami deboli. Senza ATP legato, la testa della miosina si lega strettamente all’actina. Con l’ATP legato, la miosina rilascia la subunità di actina e interagisce con un’altra subunità più in basso nel filamento sottile. Questo processo continua in ciclo, producendo il movimento. L’interazione tra miosina e actina è regolata da altre due proteine, la tropomiosina e la troponina.
Il ciclo di interazione miosina-actina è delineato come segue:
1. L’ATP si lega alla miosina e un sito di legame si apre sulla testa della miosina per interrompere l’interazione actina-miosina, l’actina viene rilasciata. L’ATP viene idrolizzato
2. un cambiamento conformazionale che sposta la proteina in uno stato “ad alta energia” fa sì che la testa della miosina cambi orientamento spostandola a legarsi con la subunità di actina più vicina alla regione chiamata disco Z rispetto alla precedente subunità di actina
3. il sito di legame viene chiuso, rafforzando il legame miosina-actina
4. segue rapidamente e la testa della miosina subisce un ulteriore cambiamento conformazionale che la riporta allo stato di riposo in cui ha iniziato
Clicca il link per accedere al video di DNAtube “A Moving Myosin Motor Protein”
http://www.dnatube.com/video/389/A-Moving-Myosin-Motor-Protein-myosin-actin-interaction
Malattia
Mutazioni in MIIA causano miopatia ad esordio precoce. Le mutazioni in MVIIA causano la sindrome di Usher.
Strutture 3D della miosina
Strutture 3D della miosina