Contenidos
- 1 Introducción
- 2 Cristalización y difracción de rayos X
- 3 Estructura
- 4 Función
- 5 Enfermedad
- 6 Estructuras 3D de la miosina
- Se trata de una enfermedad.ray diffraction
- 3 Estructura
- 4 Función
- 5 Enfermedad
- 6 Estructuras 3D de la miosina
Introducción
La miosina es una de las tres principales clases de proteínas motoras moleculares: miosina, dineína y kinesina. Como la más abundante de estas proteínas, la miosina desempeña un papel estructural y enzimático en la contracción muscular y la motilidad intracelular. La miosina se descubrió por primera vez en el músculo en el siglo XIX. La miosina es una superfamilia de proteínas que se unen a la actina, hidrolizan el ATP y transducen la fuerza. Por ello, la mayoría se localiza en las células musculares. Se compone de dominios de cabeza, cuello y cola. El dominio de la cabeza se une a la actina y se desplaza a lo largo de ella. El cuello es un enlazador y une las cadenas ligeras que tienen una función reguladora. La cola interactúa con las moléculas de carga (CBD)m. Hay 18 clases de miosina.
Se cree que la miosina no convencional no forma filamentos.
- La miosina II (MII) es la mejor estudiada. Impulsa la motilidad de alta velocidad como la contracción muscular. La MII contiene 2 cadenas pesadas (HC) que constituyen el dominio de la cabeza o motor (MD) y el dominio de la cola y 4 cadenas ligeras (LC) que se denominan LC esencial (ELC) y LC reguladora (RLC).
- La miosina III (MIII) contiene un dominio cinasa C-terminal conectado al dominio motor.
- La miosina V (MV) trabaja con motores basados en microtúbulos como la kinesina.
- La miosina VI (MVI) se mueve hacia el extremo negativo del filamento de actina.
- La miosina VII (MVII) tiene una cola corta y puede actuar en el movimiento de las membranas intracelulares.
- La miosina X (MX) es un efector descendente de la PI(3)K durante la fagocitosis.
- La miosina XI (MXI) une la membrana nuclear con el citoesqueleto.
Ver también Miosina (hebreo).
Cristalización y difracción de rayos X
La miosina se encuentra en abundancia, por lo que puede prepararse en cantidades de gramos. Durante casi 30 años la cabeza de la miosina fue resistente a la cristalización, pero en 1993 los investigadores descubrieron un mecanismo para obtener cristales de calidad de rayos X. El proceso modificó la proteína por metilación reductora. Los datos de rayos X se utilizaron para determinar la estructura terciaria de la proteína.
Estructura
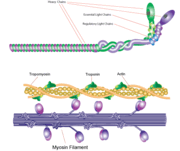
Filamento de miosina
La miosina tiene un tamaño molecular de aproximadamente 520 kilodaltons con un total de seis subunidades. Tiene dos cadenas pesadas de 220 kD que constituyen la mayor parte de la estructura global y dos pares de cadenas ligeras que varían de tamaño. La molécula es asimétrica, con una cola larga y dos cabezas globulares. Cada cadena pesada compone el grueso de una de las cabezas globulares. El subfragmento 1 (S1), también denominado cabeza de miosina, está formado por ATP, actina y dos sitios de unión de cadenas ligeras. Cada cabeza globular tiene una cadena pesada y dos cadenas ligeras para un tamaño molecular combinado de aproximadamente 130 kD.
La cabeza de miosina es asimétrica con una longitud de 165 Angstroms y 65 Angstroms de ancho, con un grosor total de unos 40 Angstroms. Alrededor del 48% de los residuos de aminoácidos de la cabeza de miosina están dominados por hélices α. En el extremo carboxilo, una larga hélice α de unos 85 Angstroms se extiende en forma de espiral hacia la izquierda. Esta hélice particular forma la región de unión de la cadena ligera del dominio globular El extremo amino de cada cadena pesada tiene un gran dominio globular que contiene el sitio de hidrólisis del ATP.
Función
Las moléculas de miosina se agregan en las células musculares para formar filamentos gruesos. La estructura en forma de varilla de estos filamentos gruesos actúa como núcleo en la unidad contráctil del músculo. La agregación de varios cientos de miosina forma una estructura bipolar que se apila en conjuntos regulares. Los músculos están formados por otra proteína llamada actina. La actina forma el filamento fino de las fibras musculares. La miosina y la actina interactúan mediante enlaces débiles. Sin la unión del ATP, la cabeza de la miosina se une fuertemente a la actina. Con el ATP unido, la miosina libera la subunidad de actina e interactúa con otra subunidad más adelante en el filamento delgado. Este proceso continúa en ciclo, produciendo el movimiento. La interacción de la miosina y la actina está regulada por otras dos proteínas, la tropomiosina y la troponina.
El ciclo de interacción miosina-actina se esquematiza de la siguiente manera:
1. El ATP se une a la miosina y se abre un sitio de unión en la cabeza de la miosina para interrumpir la interacción actina-miosina, la actina se libera. El ATP se hidroliza
2. un cambio conformacional que mueve la proteína a un estado de «alta energía» hace que la cabeza de miosina cambie de orientación moviéndola para unirse con la subunidad de actina más cerca de la región llamada disco Z que la subunidad de actina anterior
3. el sitio de unión se cierra, reforzando la unión miosina-actina
4. un sigue rápidamente y la cabeza de miosina sufre un cambio conformacional adicional que la devuelve al estado de reposo en el que comenzó
Haga clic en el enlace para acceder al vídeo de DNAtube «Una proteína motora de miosina en movimiento»
http://www.dnatube.com/video/389/A-Moving-Myosin-Motor-Protein-myosin-actin-interaction
Enfermedad
Las mutaciones en MIIA causan miopatía de inicio temprano. Las mutaciones en MVIIA causan el síndrome de Usher.
Estructuras 3D de la miosina
Estructuras 3D de la miosina