Conteúdo
- 1 Introdução
- 2 Cristalização e X-difracção de raios
- 3 Estrutura
- 4 Função
- 5 Doença
- 6 Estruturas 3D de Myosin
h2> Introdução
Myosin é uma das três principais classes de proteínas motoras moleculares: myosin, dynein, e kinesin. Como a mais abundante destas proteínas, a miosina desempenha um papel estrutural e enzimático na contracção muscular e na motilidade intracelular. A miosina foi descoberta pela primeira vez nos músculos no século XIX. A miosina é uma superfamília de proteínas que ligam a actina, hidrolisam ATP e transduzem a força. Assim, a maioria está localizada em células musculares. Composta por domínios da cabeça, pescoço e cauda. O domínio da cabeça liga a actina e move-se ao longo dela. O pescoço é um ligador e liga as cadeias ligeiras que têm uma função reguladora. A cauda interage com as moléculas de carga (CBD)m. Existem 18 classes de myosin.
Pensa-se que a miosina não convencional não forma filamentos.
- Myosin II (MII) é melhor estudada. Conduz a motilidade a alta velocidade como a contracção muscular. O MII contém 2 cadeias pesadas (HC) que constituem o domínio da cabeça ou motor (MD) e o domínio da cauda e 4 cadeias leves (LC) que são referidas como a LC essencial (ELC) e a LC reguladora (RLC).
- Myosin III (MIII) contém um domínio kinase terminal C ligado ao domínio motor.
- Myosin V (MV) funciona com motores baseados em microtubos como kinesin.
- Myosin VI (MVI) move-se em direcção à extremidade menos do filamento de actina.
- Myosin VII (MVII) tem uma cauda curta e pode actuar no movimento das membranas intracelulares.
- Myosin X (MX) é um effector a jusante de PI(3)K durante a fagocitose.
- Myosin XI (MXI) liga a membrana nuclear ao citoesqueleto.
Ver também Myosin (hebraico).
Cristalização e difracção de raios X
Miosina é encontrada em abundância, por isso pode ser preparada em quantidades de gramas. Durante quase 30 anos a cabeça da miosina foi resistente à cristalização, mas em 1993 os investigadores descobriram um mecanismo para obter cristais de qualidade de raios X. O processo modificou a proteína através da metilação redutora. Os dados dos raios X foram utilizados para determinar a estrutura terciária da proteína.
Estrutura
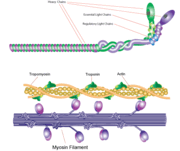
filamento de miosina
Miosina tem um tamanho molecular de aproximadamente 520 kilodaltons com um total de seis subunidades. Tem duas correntes pesadas de 220 kD que fazem a maioria da estrutura total e dois pares de correntes leves que variam em tamanho. A molécula é assimétrica, tendo uma cauda longa e duas cabeças globulares. Cada cadeia pesada compõe a maior parte de uma das cabeças globulares. O sub-fragmento-1(S1) também denominado cabeça de miosina consiste em ATP, actina, e duas cadeias ligeiras de encadernação. Cada cabeça globular tem uma cadeia pesada e duas cadeias leves para um tamanho molecular combinado de cerca de 130 kD.
A cabeça de miosina é assimétrica com um comprimento de 165 Angstroms e 65 Angstroms de largura, com uma espessura total de cerca de 40 Angstroms. Cerca de 48% dos resíduos de aminoácidos na cabeça da miosina são dominados por α helices. No terminal carboxil um longo α hélice de cerca de 85 Angstroms estende-se numa bobina de canhoto. Esta hélice em particular forma a região ligeira de ligação em cadeia do domínio globular O terminal de aminoácidos de cada cadeia pesada tem um grande domínio globular contendo o sítio da hidrólise ATP.
Função
Moléculas de agregado de miosina em células musculares para formar filamentos espessos. A estrutura semelhante a uma vara destes filamentos grossos actua como núcleo na unidade contrátil do músculo. A agregação de várias centenas de miosina forma uma estrutura bipolar que se acumula em matrizes regulares. Os músculos são constituídos por outra proteína chamada actina. A actina forma o filamento fino nas fibras musculares. A miosina e a actina interagem através de ligações fracas. Sem ATP ligada, a cabeça da miosina liga-se firmemente à actina. Com ATP ligada, a miosina liberta a subunidade de actina e interage com outra subunidade mais abaixo no filamento fino. Este processo continua em ciclo, produzindo movimento. A interacção entre a miosina e a actina é regulada por duas outras proteínas, a tropomiosina e a troponina.
O ciclo de interacção miosina-actina é delineado da seguinte forma:
1. ATP liga-se à miosina e abre-se um sítio de ligação na cabeça da miosina para perturbar a interacção actina-miosina, a actina é libertada. O ATP é hidrolisado
2. uma alteração conformacional movendo a proteína para um estado de “alta energia” faz com que a cabeça da miosina mude de orientação movendo-a para se ligar com a subunidade de actina mais próxima de uma região chamada disco Z do que a anterior subunidade de actina
3. o sítio de ligação é fechado, reforçando a ligação miosina-actina
4. segue-se rapidamente e a cabeça de myosin sofre uma mudança conformacional adicional trazendo-a de volta ao estado de repouso em que começou
Clique no link para aceder ao vídeo do DNAtube “A Moving Myosin Motor Protein”
http://www.dnatube.com/video/389/A-Moving-Myosin-Motor-Protein-myosin-actin-interaction
Doença
Mutações no MIIA causam miopatia de início precoce. As mutações em MVIIA causam a síndrome de Usher.
Estruturas 3D de Myosin
Estruturas 3D de Myosin
br>>>/p>